Mikroskopiske lægemiddeldepoter øger effektiviteten mod tumorer i dyremodeller

Biomedicinsk ingeniørforskere har udviklet en teknik til at oprette mikroskopiske "depoter" til at fange lægemidler inde i kræfttumorer. I en dyremodel, disse lægemiddeldepoter var 10 gange mere effektive til at skrumpe tumorer end brugen af de samme lægemidler uden depoterne. Kredit:Quanyin Hu
Biomedicinske ingeniørforskere har udviklet en teknik til at skabe mikroskopiske "depoter" til at fange medicin inde i kræfttumorer. I en dyremodel, disse lægemiddeldepoter var 10 gange mere effektive til at krympe tumorer end brugen af de samme lægemidler uden depoterne.
Nogle lægemidler mod kræft er mest effektive uden for kræftceller. For eksempel, det kræftbekæmpende lægemiddel TRAIL angriber en kræftcelles cellemembran, mens et andet stof, cilengitid, hæmmer væksten af blodkar omkring en tumor, sulter den for næringsstoffer.
For at forbedre effektiviteten af disse lægemidler, forskere ønsker både at forhindre dem i at blive optaget i kræftcellerne og forhindre dem i at blive vasket væk fra tumorstedet af kredsløbssystemet.
"Vi har nu fundet en måde at gøre begge dele på, ved at skabe mikroskala depoter af disse lægemidler inde i en tumor, " siger Zhen Gu, tilsvarende forfatter til et papir om arbejdet og en adjunkt i den fælles afdeling for biomedicinsk teknik ved North Carolina State University og University of North Carolina i Chapel Hill.
Forskerne begynder med at skabe en narkotikacocktail af TRAIL og cilengitide, pak derefter cocktailen ind i en "nanobærer", der er 100 nanometer (nm) i diameter. Nanobæreren er derefter besat med humant serumalbumin (HSA), et rigeligt protein i menneskeblod.
100 nm nanocarrieren er også besat med mindre nanokapsler - kun 10 nm i diameter - der er lavet af en hyaluronsyregel og indeholder et enzym kaldet transglutaminase (TG). Nanobærerne sprøjtes derefter ind i blodbanen.
Nogle kræfttumorer producerer store mængder af et enzym kaldet hyaluronidase, som nedbryder hyaluronsyre. Så, når nanobærerne trænger ind i en kræfttumor, hyaluronidasen opløser de små hyaluronsyre gel nanokapsler på deres overflade. Dette frigiver TG -enzymerne, som hjælper med at forbinde HSA -proteiner, der ligger på overfladen af andre nanobærere, skabe et tværbundet lægemiddeldepot inde i tumoren.
Størrelsen af det tværbundne depot forhindrer i vid udstrækning, at det optages af individuelle kræftceller eller hurtigt bliver fejet væk i blodbanen. Ud over, TG kan også hjælpe nanobærere med at binde til andre proteiner i tumoren, med til at holde depotet på plads.
Miljøet inde i tumoren er også surere end dets omgivelser, og denne surhed nedbryder langsomt nanobærerne.
"Dette sikrer en gradvis, vedvarende frigivelse af TRAIL og cilengitid til tumormiljøet, maksimering af lægemidlernes effektivitet, " siger Gu.
Forskerne evaluerede denne teknik ved hjælp af brystkræfttumorer i mus.
"Vi fandt ud af, at brugen af tværbundne depoter til at levere TRAIL- og cilengitid-krympede tumorer ti gange mere end brugen af den samme dosis af disse lægemidler ved hjælp af konventionelle teknikker, " siger Quanyin Hu, hovedforfatter af papiret og en ph.d. studerende i den fælles biomedicinske teknikafdeling ved NC State og UNC-Chapel Hill.
"Dette er en proof-of-concept undersøgelse, og der skal gøres yderligere arbejde for at udvikle teknikken, " siger Gu. "Men det er lovende, og vi mener, at denne strategi også kan bruges til cancerimmunterapi. Vi bliver nødt til at arbejde mere i en dyremodel, før vi fortsætter med kliniske forsøg."
Gu bemærker også, at det er for tidligt at estimere omkostninger forbundet med teknikken.
"Vi er i de tidlige faser af udviklingen af denne teknik, og vi forsøger at gøre processen enklere og mere effektiv - hvilket ville nedbringe produktionsomkostninger, " siger Gu. "Det gør det svært at vurdere, hvad de potentielle omkostninger kan være.
"Og selv om vi ikke forudser nogen væsentlige sundhedsrisici ud over dem, der er forbundet med de lægemidler, der bliver leveret, en af grundene til, at vi foretager dyreforsøg og kliniske forsøg, er at identificere eventuelle uforudsete risici. "
Papiret, "Tumormikromiljø-medieret konstruktion og dekonstruktion af ekstracellulære lægemiddelleveringsdepoter, " blev offentliggjort 19. januar i tidsskriftet Nanobogstaver . Avisen var medforfatter af Wujin Sun, Yue Lu, Jæger Bomba, og Yanqi Ye i den fælles biomedicinske ingeniørafdeling ved NC State og UNC-Chapel Hill; Tianyue Jiang fra Nanjing Tech University; og Ari Isaacson fra UNC-Chapel Hill. Arbejdet blev støttet af NC TraCS, NIH's Clinical and Translational Science Awards ved UNC-CH, tilskudsnummer 1UL1TR001111.
 Varme artikler
Varme artikler
-
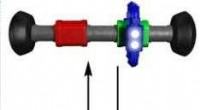 Undersøgelse måler enkelt-molekyle maskiner i aktionRotaxane, viser bevægelse af ringen til forskellige stationer langs stangen. (PhysOrg.com) -- I udviklingen af fremtidige molekylære enheder, nye displayteknologier, og kunstige muskler i nanoel
Undersøgelse måler enkelt-molekyle maskiner i aktionRotaxane, viser bevægelse af ringen til forskellige stationer langs stangen. (PhysOrg.com) -- I udviklingen af fremtidige molekylære enheder, nye displayteknologier, og kunstige muskler i nanoel -
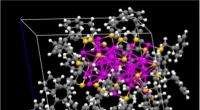 NMR bruges til at bestemme, om guldnanopartikler udviser håndhævelsePå billedet ses krystalstrukturen af et par guld-nanopartikler, der findes i en højrehåndet (nederst) og venstrehåndet (øverst) konfiguration. Disse nanopartikler lover meget som en chiral katalysat
NMR bruges til at bestemme, om guldnanopartikler udviser håndhævelsePå billedet ses krystalstrukturen af et par guld-nanopartikler, der findes i en højrehåndet (nederst) og venstrehåndet (øverst) konfiguration. Disse nanopartikler lover meget som en chiral katalysat -
 Neuroner i rygmarvsskader forbindes igen in vivo via carbon nanorørsvampeFra venstre mod højre:billede af en sund rygrad (kontrol); billede af en skadet rygrad uden implantat; billede af en skadet rygrad, hvori det biokompatible nanomateriale er blevet implanteret, og hvor
Neuroner i rygmarvsskader forbindes igen in vivo via carbon nanorørsvampeFra venstre mod højre:billede af en sund rygrad (kontrol); billede af en skadet rygrad uden implantat; billede af en skadet rygrad, hvori det biokompatible nanomateriale er blevet implanteret, og hvor -
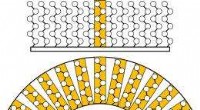 Nanoskopiske partikler modstår fuld indkapsling, viser simuleringerDe beskyttende egenskaber af en kædeleddet molekylær belægning mindskes, når, i stedet for at fastgøres til en flad overflade for at danne en ubrudt væg (fig. 1), nanopartiklernes radius er så lille,
Nanoskopiske partikler modstår fuld indkapsling, viser simuleringerDe beskyttende egenskaber af en kædeleddet molekylær belægning mindskes, når, i stedet for at fastgøres til en flad overflade for at danne en ubrudt væg (fig. 1), nanopartiklernes radius er så lille,
- ColorUNet:En ny dyb CNN-klassificeringstilgang til farvelægning
- Når et aerobatisk fly flyver på hovedet,
- Sådan testes Glass Hardness
- Kun hver fjerde vestromerske kejser døde af naturlige årsager
- Kan mikrosvømmere svømme gennem gel?
- Fremtidige muligheder for lagring af kuldioxid:Syntese af uorganiske heteroalkener


