Ny hydrogel nanoplatform, der identificerer og krymper tumorer hos mus
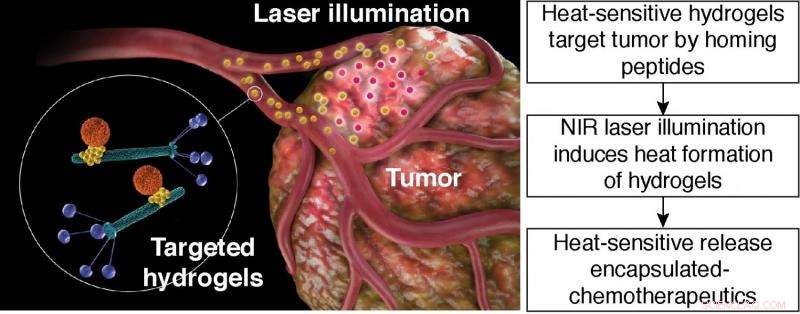
Varmefølsom frigivelse af indkapslet kemoterapeutika. Skematisk illustration af målrettet hydrogel fototermisk terapi. Målrettet hydrogel:orange partikel, liposombaseret nanocarrier; gul partikel, Guld nanopartikel; grønne stænger, bakteriofagpartikler med peptidligander vist på fagcoatingproteinet (blå). Kredit:Hosoya, et al.
(Phys.org) —Funktionelle nanopartikler er en metode til levering af lægemidler til kemoterapi. Imidlertid, Det har vist sig svært at få nanopartikler til at målrette tumorstedet. En metode, forskere har brugt til at målrette kræftceller, er at skabe hydrogeler fremstillet af filamentøse bakteriofager (fag) og guldnanopartikler. Peptidbindende ligander kan inkorporeres i fagdelen af hydrogelen, der derefter vil målrette mod kendte carcinomceller.
En tværfaglig gruppe forskere fra forskellige universiteter i Japan, USA., og Tyskland har udviklet en hydrogel -platform, der kan målrette tumorer, levere ikke-invasiv billeddannelse, og frigive et kemoterapeutisk lægemiddel. De har demonstreret deres platform i både in vitro -undersøgelser og i musemodeller. Derudover de demonstrerer, at deres platform er generaliserbar til forskellige mål og kemoterapeutika. Deres arbejde vises i Procedurer fra National Academy of Sciences .
Hosoya, et al.s hydrogel -platform består af bakteriofag, guld nanopartikler, og bærere i nanostørrelse, såsom liposomer eller mesopourøse silica-partikler. I denne indstilling, fagpartikler er i stand til at genkende specifikke molekyler på tumorcellerne. Guldnanopartiklerne fungerer som en "reporter" til distribution af hydrogel. Nanobæreren transporterer forskellige kemikalier eller farmaceutisk gods. Nanocarrier frigiver last på en bestemt stimulus, såsom varme.
I det aktuelle arbejde, Hosoya, et al. beviste først, at varmefølsomme liposomer (HSL'er) ville tjene som en formidabel varmefølsom bærer. I teorien, da HSL begynder at smelte, det frigiver det lægemiddel, der er inkorporeret i det. Brug af calcein, et fluorescerende aktivt molekyle, de fastslog, at HSL frigav calcein ved at nå 40 o C, som forudsagt. Da HSL blev efterladt ved en konstant temperatur (42 o C), det frigav alt calcein inden for 10 minutter. Hosoya, et al. beviste derefter, at disse HSL'er stadig var lydhøre over for ændringer i temperatur, når de blev inkorporeret i hydrogelplatformen.
Det næste trin var at demonstrere, at de HSL-holdige hydrogeler reagerede på NIR-opvarmning i en matrix. Forfatterne brugte agarosegel som deres modelsystem. De fandt ud af, at den HSL-holdige hydrogel reagerede på NIR-opvarmning, og da lasereffekten steg, temperaturen på hydrogel steg. De afgjorde derefter, om NIR -opvarmning ville udløse frigivelsen af doxorubicin (dox), et kemoterapeutisk middel. De var i stand til at producere en "reproducerbar og robust foton-dosisafhængig stigning i fluorescensintensitet."
For at bestemme varmefordelingen i hydrogel fra NIR, de brugte magnetisk resonans temperaturafbildning på de HSL-holdige hydrogeler på agaroseplatformen. De termiske gradientbilleder bekræftede, at den centraliserede varme blev produceret af hydrogel via NIR -laseren. De brugte gadolinium-indkapslede HSL-holdige hydrogeler til at bekræfte, at lægemiddelfrigivelse fandt sted på stedet for laserstrålen.
Selvom disse resultater viser, at frigivelse af lægemidler kan kontrolleres ved hjælp af NIR, de mangler stadig at teste, om systemet kan målrette mod kræftstedet. At gøre dette, Hosoya, et al inkorporeret en ligand, der har et veletableret cyklisk peptid, der binder til CRKL. CRKL-bindende fagpartikler er målrettet EF43. fgf-4 brystkræftceller. Brug af rhodaminmærkede HSL-holdige hydrogeler, de demonstrerede, at fagen målrettede carcinomcellerne, bekræfter, at det stadig bevarer sine bindende egenskaber, selv når det er inkorporeret i nanoplatformen.
De lavede derefter in vivo -test på mus. De sporede placeringen og virkningerne af deres HSL-holdige hydrogelplatform hos mus, der havde EF43. fgf-4 brystkræft. Optiske fluorescensbilledstudier viste, at tumoren var synlig hos mus behandlet med det målrettede hydrogel -system sammenlignet med kontroller. Analyse af tumorer efter 24 timer afslørede, at guld nanopartikler, målrettet fag, og HSL'er var placeret inden i tumoren. Yderligere undersøgelser for at se, om deres system derefter kunne frigive et kemoterapeutisk middel ved hjælp af NIR på tumorstedet, viste sig også at være vellykkede. Forfatterne observerede reduceret tumorvækst hos mus med HSL-holdige hydrogeler med dox, og bekræftede deres resultater ved hjælp af matematisk modellering.
Endelig, at teste alsidigheden af deres hydrogel nanoplatform, Hosoya, et al. inkorporerede mesoporøse silica -nanopartikler (MSNP) i hydrogelsystemet. MSNPs kemiske egenskaber gør det muligt at pakke forskellige kemoterapeutika. De testede, om MSNP-holdige hydrogeler kunne levere FITC i to forskellige kræftmodeller, den samme brystkræftmodel, der blev brugt tidligere (EF43. fgf-4 ) og en model for prostatakræft. De fandt målrettet binding til de to kræftformer, og undersøgelser med dox viste et fald i tumorstørrelse.
Dette arbejde demonstrerer en hydrogel-platform, der ikke ændrer de fysiske eller kemiske egenskaber ved kendte nanocarrier-systemer, såsom varmefølsomme liposomer eller mesoporøse silica-nanopartikler. Denne platform giver mulighed for målretning, varmeinduceret levering, og er både alsidig og reproducerbar. Med yderligere undersøgelser, dette system kan være en generel, robust metode til målrettet lægemiddellevering.
© 2016 Phys.org
 Varme artikler
Varme artikler
-
 Forskere, der først simulerede en storstilet virus, M13Molekylær visning af en grovkornet model baseret på den oprindelige struktur af M13 hovedpelsproteiner Kredit:SUTD Atomistiske simuleringer er et kraftfuldt værktøj til at studere bevægelser og in
Forskere, der først simulerede en storstilet virus, M13Molekylær visning af en grovkornet model baseret på den oprindelige struktur af M13 hovedpelsproteiner Kredit:SUTD Atomistiske simuleringer er et kraftfuldt værktøj til at studere bevægelser og in -
 Ny mikroskopimetode til hurtig og pålidelig 3-D-billeddannelse af krumme lineære nanostrukturerEn overlejret, vippefri elektronmikroskopi stereobillede (farvefiltreret) af carbon nanosfærer dekoreret med nanopartikler. De samme strukturer vises i rødt og blåt, og nanopartiklerne forskydes lidt
Ny mikroskopimetode til hurtig og pålidelig 3-D-billeddannelse af krumme lineære nanostrukturerEn overlejret, vippefri elektronmikroskopi stereobillede (farvefiltreret) af carbon nanosfærer dekoreret med nanopartikler. De samme strukturer vises i rødt og blåt, og nanopartiklerne forskydes lidt -
 Rekombinant E. coli som biofaktor til biosyntese af forskellige nanomaterialerBiosyntesen af forskellige nanomaterialer ved hjælp af rekombinant E coli . Dette skematiske diagram viser den overordnede konceptualisering af biosyntesen af forskellige enkelt- og multi-elemen
Rekombinant E. coli som biofaktor til biosyntese af forskellige nanomaterialerBiosyntesen af forskellige nanomaterialer ved hjælp af rekombinant E coli . Dette skematiske diagram viser den overordnede konceptualisering af biosyntesen af forskellige enkelt- og multi-elemen -
 3D-struktur af kunstigt designet proteinnanopartikel TIP60 belyst ved kryo-elektronmikroskopiTres fusionsproteiner af et pentamerisk Sm-lignende protein (PDB ID:3BY7) og et dimerisk MyoX-spiraldomæne (PDB ID:2LW9) samles selv til et proteinnanopartikelkompleks, TIP60 (Truncated Icosahedral Pr
3D-struktur af kunstigt designet proteinnanopartikel TIP60 belyst ved kryo-elektronmikroskopiTres fusionsproteiner af et pentamerisk Sm-lignende protein (PDB ID:3BY7) og et dimerisk MyoX-spiraldomæne (PDB ID:2LW9) samles selv til et proteinnanopartikelkompleks, TIP60 (Truncated Icosahedral Pr
- Økologisk betydning af Algae
- Dyr og planter i Grækenland
- Robotedderkopper til at udforske månen
- En personlighedstest for annoncer:Maskinlæringsalgoritmer kan tilpasse annoncer til individuelle fo…
- Hidtil uset 3-D rekonstruktion af præ-columbiansk kranie fra Caribien og Sydamerika
- NASAs SLS-måneraket gør klar til næste pitstop på vej til Kennedy Space Center


