Ny biomarkør for hjertesygdomme ved hjælp af atomkraftmikroskopi
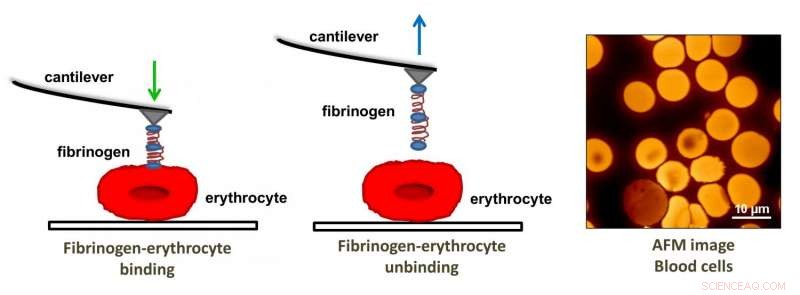
Atomkraftmikroskopi blev brugt til at bestemme bindingskraften mellem fibrinogen og erytrocytreceptoren. Kredit:Filomena A. Carvalho og Nuno C. Santos
(Phys.org)—Forskere fra University of Lissabon og North Lisbon Hospital Center (Centro Hospitalar Lisboa Norte) gennemførte en pilotundersøgelse, der demonstrerede, hvordan atomic force microscopy (AFM) kunne bruges som et ikke-invasivt diagnostisk værktøj til kronisk hjerte sygdom. Deres arbejde vises i det seneste nummer af Natur nanoteknologi .
Verdenssundhedsorganisationen anslår, at 17,5 millioner mennesker dør årligt på grund af hjerte -kar -sygdomme. Iskæmisk kardiomyopati er den mest almindelige årsag til hjertesvigt og kommer typisk med en dårlig prognose for patienter. Iskæmisk kronisk hjertesvigt (CHF) opstår, når hjertet ikke kan modtage nok blod, ofte på grund af arteriel blokering eller ar fra hjerteanfald. Fordi CHF er så udbredt, forskere har søgt biomarkører for at indikere patientrisiko for gentagelse, herunder diagnose af iskæmisk kontra ikke-iskæmisk CHF.
Ved at bruge AFM-teknikker og bygge på deres tidligere undersøgelser af, hvordan fibrinogen, et protein, der findes i blodplasma, binder sig til erytrocytternes cellemembran (dvs. røde blodlegemer), Ana Filipa Guedes, Filomena A. Carvalho, Ines Malho, Nuno Lousada, Luis Sargento, og Nuno C. Santos observerede molekylære ændringer, der forekommer hos patienter med iskæmisk CHF. Disse ændringer kan bruges til at vurdere patientrisiko samt tilvejebringe potentielle mål for opdagelse af lægemidler. De testede femten patienter med iskæmisk CHF, femten med ikke-iskæmisk CHF, og femten raske patienter som kontrolgruppe.
Atomkraftmikroskopi giver mulighed for undersøgelser på molekylært niveau, fordi dens probespidsstørrelse er i størrelsesordenen nanometer i diameter. I denne undersøgelse blev AFM brugt til at undersøge bindingsstyrken og frekvensen mellem fibrinogen og αvβ3-receptoren på erytrocytoverfladen samt erytrocytelasticitet via spidspenetrationsdybde.
AFM -spidsen blev funktionaliseret med fibrinogenmolekyler og sat i kontakt med receptorerne på erytrocytoverfladen. Bindingsstyrken blev fundet ved kraftmålinger, når spidsen blev trukket væk fra receptorstederne. Guedes, et al. fandt, at bindingsstyrken og frekvensen var forskellig i hver type prøve. Patienter med iskæmisk CHF viste den stærkeste bindingsstyrke, men den laveste bindingsfrekvens. Ikke-iskæmisk CHF var næste, efterfulgt af kontrolgruppen, som viste den højeste bindingsfrekvens, men den laveste bindingsstyrke mellem fibrinogen og αvβ3-receptoren.
Erythrocytter vides at ændre form baseret på deres fysiologiske miljø. Erytrocytter vil ændre deres form, når en høj eller lav forskydningskraft, eller flowhastighed, anvendes på dem. Dette hjælper de røde blodlegemer til at flyde jævnt og ikke bliver tilstoppede. Derudover visse sygdomme kan forårsage ændringer i erytrocyttens form. En erytrocyt evne til at ændre form er baseret på, hvor elastisk membranen er.
For at bestemme erytrocytelasticiteten, Guedes, et al. kiggede på AFM spids penetrationsdybde. De fandt, at røde blodlegemer fra patienter med ikke-iskæmisk CHF havde en højere gennemsnitlig stivhed end celler fra den iskæmiske gruppe og kontrolgruppen. Imidlertid, røde blodlegemer fra patienter med iskæmisk CHF havde højere cellepenetrationsdybde. Viskositetsundersøgelser viste også, at celler fra ikke-iskæmiske patienter var højere end iskæmiske patienter og kontrolgruppen. Cellestivheden kan være en af årsagerne til en højere forekomst af kardiovaskulære hændelser på grund af blodpropper.
Endelig, AFM-studierne var korreleret med patientens kliniske data. Efter 12 måneder var de patienter, der havde en højere bindingskraft mellem fibrinogen og erytrocytreceptoren, mere tilbøjelige til at blive indlagt på grund af en kardiovaskulær komplikation end de to andre grupper. Statistiske undersøgelser viser en sammenhæng mellem bindingsstyrke og indlæggelse inden for de næste 12 måneder.
Selvom dette kun er et pilotstudie med et begrænset antal patienter, forfatterne påpeger, at disse resultater viser, at AFM er et lovende nanoværktøj til at se på interaktionen mellem fibrinogen og erytrocytbinding, som kan bruges til at identificere de patienter, som har øget risiko for en efterfølgende kardiovaskulær hændelse.
© 2016 Phys.org
 Varme artikler
Varme artikler
-
 Undersøgelse af miljøpåvirkningen af nanosølvKredit:Shutterstock Når det kommer til materialer, der bruges i kampen mod bakterier, sølv er måske ikke det første stof, der kommer til at tænke på. Imidlertid, ædelmetallet er blevet brugt i den
Undersøgelse af miljøpåvirkningen af nanosølvKredit:Shutterstock Når det kommer til materialer, der bruges i kampen mod bakterier, sølv er måske ikke det første stof, der kommer til at tænke på. Imidlertid, ædelmetallet er blevet brugt i den -
 Transportabel, hurtig DNA-test kan påvise ebola og andre patogenerEbola virus, isoleret i november 2014 fra patientblodprøver opnået i Mali. Virusset blev isoleret på Vero-celler i en BSL-4-suite på Rocky Mountain Laboratories. Kredit:NIAID Ved at bruge tekniske
Transportabel, hurtig DNA-test kan påvise ebola og andre patogenerEbola virus, isoleret i november 2014 fra patientblodprøver opnået i Mali. Virusset blev isoleret på Vero-celler i en BSL-4-suite på Rocky Mountain Laboratories. Kredit:NIAID Ved at bruge tekniske -
 Fleksibel, papirbaseret superkondensator kunne forbedre ydeevnen af hybride elbilerFleksibel, solid-state superkondensatorer i to former, og en superkondensator er bøjet mere end 90 grader. Billedkredit:Hu, et al. ©2012 American Institute of Physics (PhysOrg.com) - Forskere ved,
Fleksibel, papirbaseret superkondensator kunne forbedre ydeevnen af hybride elbilerFleksibel, solid-state superkondensatorer i to former, og en superkondensator er bøjet mere end 90 grader. Billedkredit:Hu, et al. ©2012 American Institute of Physics (PhysOrg.com) - Forskere ved, -
 Sætter et nyt spin på plasmonicsMagnetiske nanopartikler arrangeret i arrays sætter et twist på lyset:afhængigt af afstanden mellem nanopartiklerne, én lysfrekvens (synlig for det menneskelige øje ved dets farve) resonerer i én retn
Sætter et nyt spin på plasmonicsMagnetiske nanopartikler arrangeret i arrays sætter et twist på lyset:afhængigt af afstanden mellem nanopartiklerne, én lysfrekvens (synlig for det menneskelige øje ved dets farve) resonerer i én retn
- Amerikanske boregodkendelser stiger på trods af Biden-klimaløftet
- Team udvikler ultrafølsom biosensor fra molybdenit halvleder
- Afslappende DNA-tråde ved hjælp af nanokanaler
- Digital penicillinproduktion
- Lab bygger autopilotsoftware, der tillader UAV'er at svæve på termik
- Forståelse af iltreducerende enzymer


