Termotriggeret frigivelse af et genomredigeringsmaskineri af modificerede guldnanopartikler til tumorterapi
Kredit:Wiley
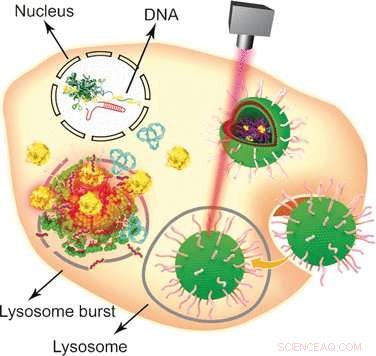
Genredigering er et af de hotteste emner inden for kræftforskning. Et kinesisk forskerhold har nu udviklet en guld-nanopartikel-baseret multifunktionel vehikel til at transportere "gensaksen" til tumorcellens genom. Som forfatterne beretter i tidsskriftet Angewandte Chemie , deres ikke-virale transport- og frigivelsesplatform af genredigeringssystemer har den yderligere fordel, at de kombinerer hypertermisk cancerterapi med genetisk modifikation.
Siden opdagelsen i 2002, den bakterielle antivirale forsvarsstrategi CRISPR-Cas9 har vist sig som en af de mest populære genomteknologiske tilgange med brede anvendelser inden for molekylærbiologi og biomedicin. Ved at bruge CRISPR-Cas9-systemet, et målgen kan redigeres, slået ud, eller indsat i eukaryote celler på en relativt enkel og bekvem måde. Imidlertid, en af dens svage punkter er dens store størrelse, hvilket kræver brug af specifikke ikke-virale vehikler til at levere det store plasmid til kernen. Ved at kombinere etablerede lipidformuleringer med guld nanopartikler, Wenfu Zheng og hans kolleger fra National Center for NanoScience and Technology, Beijing, Kina, i samarbejde med medicinske forskere i Japan og Kina, har fundet og testet et multifunktionelt værktøj baseret på simple komponenter, der effektivt leverer og frigiver CRISPR-Cas9-systemet til tumorer. Laserbestråling blev brugt til at adskille lipid-nanogold-vehiklet efter dets indtræden i tumorcellerne og muliggøre CRISPR-Cas9-genredigering. Knockoutet af det målrettede gen førte derefter til apoptose og tumorvækstinhibering.
Guld nanopartikler er særligt attraktive bærere for forskellige biologiske molekyler på grund af deres lette modifikation, stabilitet, og lysbestrålingsrespons. For at omdanne dem til et alsidigt biologisk transport- og leveringskøretøj, forskerne knyttede først Tat-peptider - som letter krydsningen af cellekernemembranen - til guld-nanopartikler. Derefter, CRISPR-Cas9-plasmidet, der indeholdt RNA'et, der var målrettet mod Plk-1-genet - hvis knockout ville forringe tumorcellefunktionen alvorligt - blev knyttet til Tat-peptiderne gennem elektrostatiske interaktioner, så de ville frigive deres belastning lige efter at være kommet ind i kernen. Endelig, det nanopartikulære system blev belagt med en formulering af lipider for at forbedre cellulær optagelse.
For at teste systemet, celler og tumorbærende mus blev begge administreret med det CRISPR-Cas9-plasmid-bærende nanogold-vehikel, og frigivelsen af genredigeringsmaskinen blev udløst af en laser. "I dette studie, lysbestråling forårsagede frigivelsen af Tat-peptidet fra guldnanopartiklerne på en tids- og laserintensitetsafhængig måde, " forklarede forfatterne. Andre tilgange er også mulige, som de påpegede:da guldnanopartiklerne opvarmes ved bestråling, de kunne selv tjene som termoterapeutiske midler. Sammenfattende, dette relativt enkle design, der indebærer guld nanopartikler, peptider, og lipider samlet til et sofistikeret multifunktionelt bærer/frigivelsessystem kunne tjene som en multifunktionel leveringsplatform til forskellige aspekter af genterapi.
 Varme artikler
Varme artikler
-
 Et realistisk blik på løfterne og farerne ved nanomedicinEr det nye område for nanomedicin en betagende teknologisk revolution, der lover bemærkelsesværdige nye måder at diagnosticere og behandle sygdomme på? Eller varsler det frigivelsen af farlige nanop
Et realistisk blik på løfterne og farerne ved nanomedicinEr det nye område for nanomedicin en betagende teknologisk revolution, der lover bemærkelsesværdige nye måder at diagnosticere og behandle sygdomme på? Eller varsler det frigivelsen af farlige nanop -
 Forskere perfektionerer knudebindingsteknikker med molekylær strengKredit:University of Manchester En gruppe kemikere fra Manchester har for første gang bundet en række mikroskopiske knob ved hjælp af individuelle molekyler, indvarslingen af en form for vævning
Forskere perfektionerer knudebindingsteknikker med molekylær strengKredit:University of Manchester En gruppe kemikere fra Manchester har for første gang bundet en række mikroskopiske knob ved hjælp af individuelle molekyler, indvarslingen af en form for vævning -
 Brug af kulnanorør til at styrke grafenbaserede membraner, der bruges til afsaltningEn atomar tynd grafen-nanomesh-membran med stort område med fremragende mekanisk styrke til ionisk og molekylær nanofiltrering. Kredit:Quan Yuan Et team af forskere fra Kina, USA og Japan har udvi
Brug af kulnanorør til at styrke grafenbaserede membraner, der bruges til afsaltningEn atomar tynd grafen-nanomesh-membran med stort område med fremragende mekanisk styrke til ionisk og molekylær nanofiltrering. Kredit:Quan Yuan Et team af forskere fra Kina, USA og Japan har udvi -
 Belægning af ædelmetal nanopartikler med silicaScanningelektronmikroskopibillede, der viser silica-coatede sølvnanopartikler fremstillet ved en enkel og effektiv alkoholfri proces (indsat viser billede med høj forstørrelse). Kredit:Royal Society o
Belægning af ædelmetal nanopartikler med silicaScanningelektronmikroskopibillede, der viser silica-coatede sølvnanopartikler fremstillet ved en enkel og effektiv alkoholfri proces (indsat viser billede med høj forstørrelse). Kredit:Royal Society o
- Rusland slutter sig til Paris -klimaaftalen
- Det britiske firma i Facebook-rækken suspenderer CEO efter nye afsløringer
- Billede:CubeSats installeret udenfor stationer Kibo laboratoriemodul
- Falske nyheder sænker tilliden til mainstream-medier på tværs af partigrænser, undersøgelse fin…
- Forskere udvikler bredspektrede hæmmere af influenzavirus
- Astronomer registrerer emission af methanol-maser mod nærliggende galakse


