Stjerneformede nanopartikler, der først frigiver deres lægemiddellast efter indtrængen i celler
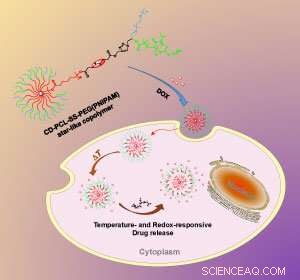
Ændringen i temperatur og kemisk miljø inde i cellen udløser nanopartiklerne til at frigive sin lægemiddellast. Kredit:The Royal Society of Chemistry
A*STAR-forskere har udviklet lægemiddelleveringspartikler i nanoskala, der kan mærke deres omgivelser, og frigive deres nyttelast først efter indtastning af en celle, en opdagelse, der kunne gøre mange eksisterende lægemidler mere effektive.
De nye nanopartikler, udviklet af Zibiao Li fra A*STAR Institute of Materials Research and Engineering og hans samarbejdspartnere, er en betydelig opgradering fra tidligere generationer af polymerbaserede nanopartikler til levering af lægemidler. Tidlige eksempler bestod typisk af simple polymerkæder med en polær, hydrofilt hoved og et upolært, hydrofob hale. I vand, disse kæder samles naturligt i kugler, med deres hydrofobe haler, der alle peger indad for at danne en ikke-polær kerne. Kernen dannede et godt sted for lægemiddelmolekyler at putte sig. I blodbanen, imidlertid, disse tilslag har tendens til at blive revet fra hinanden.
Li og hans kolleger brugte de nyeste polymersynteseteknikker til at skabe enkeltmolekyle nanopartikler. Frem for et selvsamlet aggregat af separate polymerer, teamet syntetiserede en mere robust struktur, hvor polymerkæderne var stærkt kovalent bundet til en central kerne. Syntesen begyndte med beta-cyclodextrin, et cirkulært sukkermolekyle med 21 hydroxylgrupper på overfladen. Hydroxylgrupperne dannede de kemiske ankre, hvorfra holdet konstruerede nanopartiklernes mange lange, Y-formet, multifunktionelle polymerarme.
"Den største udfordring ved at lave [nanopartikler] var at integrere forskellige syntetiske metoder i et makromolekylært design, " siger Li. Ved en af enderne af hver Y-formet gren, holdet vedhæftede en temperaturfølsom polymer kaldet PNIPAM. Ved stuetemperatur strækker PNIPAM-polymeren sig udad, men kollapser når kropstemperaturen 37 grader celsius, er nået, lader nanopartiklens lægemiddelmolekylfragt slippe ud.
Midtvejs langs hver polymerarm, holdet installerede en svovl-svovlbinding. Når partiklerne kommer ind i en celle, de møder høje niveauer af glutathion, et molekyle, der spalter svovl-svovlbindinger. Således er nanopartiklernes ydre polymerbelægning klippet af, og stoffet frigives endnu hurtigere.
Da holdet testede denne effekt med et lægemiddel mod kræft kaldet doxorubicin, dobbeltvirkningseffekten var tydelig. "Ændringen fra stuetemperatur til kropstemperatur, og virkningen af glutathion, viste synergistisk og hurtig frigivelse af lægemidlet, " siger Li. Ved lavere temperaturer, eller i fravær af glutathion, frigivelsen af lægemidler var betydeligt langsommere, han siger.
"Den næste plan er at integrere ny funktionalitet, til præcis frigivelse af lægemidlet til målrettet kræftbehandling, " siger Li. Den ene ende af hver Y-formet gren kunne funktionaliseres med et molekyle, der klæber selektivt til kræftceller, at levere lægemidlet præcis, hvor det er nødvendigt.
 Varme artikler
Varme artikler
-
 Calcium:God til knogler, godt for kulturbevaringKredit:American Chemical Society Når det kommer til kulturarvssteder, der er få ting historikere ikke ville gøre for at bevare dem til fremtidige generationer. I særdeleshed, stenbygninger og skul
Calcium:God til knogler, godt for kulturbevaringKredit:American Chemical Society Når det kommer til kulturarvssteder, der er få ting historikere ikke ville gøre for at bevare dem til fremtidige generationer. I særdeleshed, stenbygninger og skul -
 Stærke tænder:Nanostrukturer under stress gør tænderne modstandsdygtige over for revnerIllustration af dentins komplekse biostruktur:dentale tubuli (gule hule cylindre, diametre ca. 1 mikrometer) er omgivet af lag af mineraliserede kollagenfibre (brune stænger). De små mineralske nanopa
Stærke tænder:Nanostrukturer under stress gør tænderne modstandsdygtige over for revnerIllustration af dentins komplekse biostruktur:dentale tubuli (gule hule cylindre, diametre ca. 1 mikrometer) er omgivet af lag af mineraliserede kollagenfibre (brune stænger). De små mineralske nanopa -
 Team laver korte nanorørprøver i hånden for dramatisk at reducere produktionstidenTrådlignende fibre skabt med en ny, hurtig metode på Rice University er lavet af milliarder af kulstof nanorør, der hurtigt kan justeres ved hjælp af forskydningskraft mellem dias. Kredit:Komplekse fo
Team laver korte nanorørprøver i hånden for dramatisk at reducere produktionstidenTrådlignende fibre skabt med en ny, hurtig metode på Rice University er lavet af milliarder af kulstof nanorør, der hurtigt kan justeres ved hjælp af forskydningskraft mellem dias. Kredit:Komplekse fo -
 Risici ved nanomaterialer under mikroskopetNanoteknologi er konstant stigende med hensyn til forskning, økonomisk og social betydning. Imidlertid, arbejdet med syntetiske nanomaterialer skjuler også risici. Empa har lavet en undersøgelse for F
Risici ved nanomaterialer under mikroskopetNanoteknologi er konstant stigende med hensyn til forskning, økonomisk og social betydning. Imidlertid, arbejdet med syntetiske nanomaterialer skjuler også risici. Empa har lavet en undersøgelse for F
- Flerårig ubådskløft-undersøgelse udfordrer lærebogsteorier om turbiditetsstrømme
- Global havde-iltning kvantificeret
- Amazons håber, at Prime Day ikke går til hundene
- US ATLAS fase I -opgradering afsluttet
- Forbedring af sikkerheden, da kunstig intelligens flytter til smartphones
- Forløbere for et katastrofalt sammenbrud


