DNA -nanostrukturer passer til fremtidige missioner

Forskerne samlede tre forskellige DNA -nanostrukturer, herunder en C-formet og to tønde-lignende strukturer, og viste ved transmissionselektronmikroskopi, at de var beskyttet af deres kombinerede belægnings- og tværbindingsstrategi. Kredit:Wyss Institute ved Harvard University
At slå kræft og en overflod af andre sygdomme afhænger ikke kun af at få fat i de rigtige lægemidler - det handler også om at få dem til de rigtige steder i kroppen, samtidig med at skader på sunde væv minimeres. DNA-nanostrukturer såsom selvsamlende DNA-origami, der foldes i definerede former, er lovende køretøjer til levering af medicin og diagnostik, og forskellige vaccinationsstrategier. Dette er fordi de kan fleksibelt funktionaliseres med små molekyler og proteinlægemidler, og immunogene antigener, samt funktioner, der letter deres levering til specifikke målceller og væv. Ud over, de er biokompatible og bionedbrydelige.
Det store potentiale ved DNA -nanostrukturer til forskellige biomedicinske anvendelser, imidlertid, er stadig hæmmet af deres begrænsede stabilitet i kroppens væv og blod. William Shih, Ph.d. og hans team har nu udtænkt en let, effektiv, og skalerbar kemisk tværbindingstilgang, der kan give DNA-nanostrukturer den stabilitet, de har brug for som leveringskøretøjer til medicin og diagnostik. Deres undersøgelse er offentliggjort i Journal of the American Chemical Society ( JACS ).
"For at hjælpe med at opfylde det ekstraordinære løfte om DNA -nanostrukturer, vi udviklede en bredt anvendelig kemisk tilgang til at øge deres modstandsdygtighed over for nedbrydning, "sagde William Shih, et kernefakultetsmedlem ved Wyss Institute, der leder projektet i instituttets Molecular Robotics Initiative. "Ved at ændre DNA -nanostrukturer i to lette trin, vi kan dramatisk forbedre deres overlevelse, som fjerner en central flaskehals i oversættelsen af disse nanodelenheder til løsninger på en række forskellige medicinske problemer. "
DNA origami samles typisk fra en lang DNA-streng, der foldes til en defineret 3-D-form på nanometers skala ved hjælp af flere korte hæfteklammer, der forbinder forskellige dele af strukturen i rummet. DNA -rygraden er stærkt negativt ladet, hvilket betyder, at det kan være problematisk at bringe forskellige dele af foldestrenge i nærheden af hinanden, fordi de naturligvis afviser hinanden, ligner de negative overflader af to magneter. For at overvinde disse frastødende kræfter, forskere tilføjer normalt et overskud af positivt ladede ioner som magnesiumioner (Mg 2 + ) til deres foldningsreaktioner, der dækker DNA's negative ladninger.
Tit, imidlertid, den tilsatte Mg 2 + ioner vedligeholdes ikke tilstrækkeligt i 3D-origami-strukturer. Især når det introduceres i kroppen, hvor normal Mg 2 + koncentrationerne er meget lavere, Mg 2 + ioner lækker fra nanostrukturer og får dem til at gå i opløsning. Ud over, DNA -nanostrukturer er konstant under angreb af DNA -nukleaseenzymer, der naturligt produceres i kroppen og nedbryder frie DNA -molekyler, reducerer deres stabilitet dramatisk, som normalt måles som deres halveringstid. Det følger logisk, at ved at forstyrre den strukturelle integritet af DNA -nanostrukturer, disse interne og eksterne kræfter begrænser også frigivelsen af lægemidler eller tilgængeligheden af diagnostiske reportermolekyler.
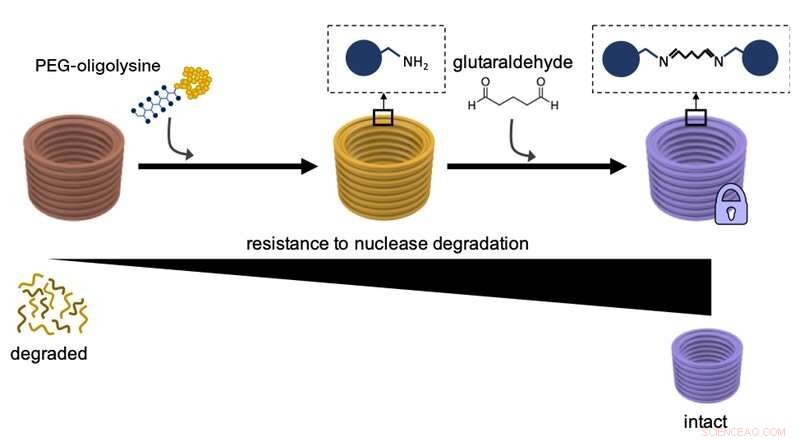
Dette diagram forklarer, hvordan man først belægger DNA-nanostrukturer med PEG-oligolysiner, og derefter tværbinder kemisk forskellige PEG-oligolysiner med glutaraldehyd som et tværbindingsmiddel deres modstandsdygtighed over for nedbrydning af DNA-nukleaseenzymer og generel stabilitet. Kredit:Wyss Institute ved Harvard University
I en tidligere undersøgelse, Shih og hans team fandt en måde at overvinde behovet for overdreven mg 2 + koncentrationer for at stabilisere DNA -nanostrukturer. Ved i det væsentlige at belægge overfladerne af de store DNA-strenge med et forholdsvis lille diskret neutraliserende middel, der bærer flere positive ladninger og er kendt som PEG-oligolysin (eller PEGyleret oligolysin), de havde opfundet en metode, der let kunne anvendes til at stabilisere DNA -nanostrukturer i alle former og former på en skalerbar måde. PEGyleret oligolysin består af korte kæder af den positivt ladede aminosyre lysin - en af byggestenene i proteiner - som er fast knyttet til polyethylenglycol (PEG), et polymert molekyle, der er i stand til at binde flere oligolysinkæder. Forskerne mener, at PEG fungerer som en "molekylær børste" for at forhindre sammenlægning af de neutraliserede nanopartikler.
I modsætning til individuel Mg 2 + ioner, der, i teorien, hver kan kun neutralisere to af de mange negative ladninger, der udsættes af DNA -rygraden med deres to positive ladninger, PEGyleret oligolysin kan dække flere negative DNA -ladninger på én gang, og danner således et stabilt "elektrostatisk net", der dækker overfladen af DNA -nanostrukturer. Stabiliteten af de overtrukne nanostrukturer blev endda opretholdt i levende celler og mus, viser, at holdet var på rette vej.
"Ved hjælp af denne enkle strategi, vi kunne forlænge overlevelsen af DNA-nanostrukturer med cirka 400 gange med halveringstider op til 36 timer i fysiologiske miljøer, der også indeholdt normale nukleaseniveauer, "sagde førsteforfatter Frances Anastassacos, Ph.d., som på studietidspunktet var en kandidatstuderende, der arbejdede med Shih. "Imidlertid, dette manglede stadig det, der er nødvendigt i nogle egentlige terapeutiske anvendelser. PEGyleret oligolysin havde stadig en tendens til at falde af DNA'et til en vis grad. "
I JACS undersøgelse, holdet løste nu denne resterende del af "stabilitetsproblemet". "Vi knyttede i det væsentlige yderligere knuder til det elektrostatiske net ved hjælp af et kemisk tværbindingsreagens kendt som 'glutaraldehyd', der stærkt binder forskellige PEGylerede oligolysiner på overfladen af DNA-nanostrukturer, "sagde Anastassacos." I nærvær af DNA -nukleaseniveauer, der langt overstiger niveauet i menneskekroppen, deres overlevelse strakte sig ud over 300 timer. Den 400 gange stigning i stabilitet, som vi observerede med PEGyleret oligolysin alene, blev forhøjet med yderligere 250 gange, som rammer mærket for kliniske anvendelser. "
Andre forsøg, der lykkedes at stabilisere DNA-nanostrukturer med kemiske modifikationer, baserede sig hovedsageligt på re-design af eksisterende strukturer, så bestemte steder inden for deres 3D-strukturer ville blive tilgængelige for den indsatte kemi. I modsætning, "vores tilgang kan udføres på enhver DNA -nanostruktur, og dens lethed og omkostningseffektivitet kunne betydeligt styrke oversættelsen af mange allerede eksisterende og nydesignede terapeutiske og diagnostiske strukturer, "sagde Zhao Zhao, Ph.d., som er co-first forfatter på undersøgelsen og tidligere postdoktor på Shihs team.
I deres undersøgelse, Shih og hans team havde til formål at maksimere stabiliteten af DNA -nanostrukturer. Forskerne, imidlertid, tror, at ved yderligere at variere tværbindingstrinnet, halveringstiden for strukturerne kunne finjusteres til specifikke applikationer, der kræver, at lastmolekyler bliver tilgængelige på forskellige tidspunkter og over forskellige tidsintervaller. De fandt allerede ud af, at deres beskyttelsesmetode ikke forstyrrede bindingen af lastmolekyler til de modificerede strukturer og optagelsen af strukturerne af dyrkede humane celler. Nu, klinisk oversættelse kan begynde.
 Varme artikler
Varme artikler
-
 Ny metode kan afsætte nanomaterialer på fleksible overflader og 3D-objekterDysen affyrer en stråle af kulstofnanorør med heliumplasma slukket og tændt. Når plasmaet er slukket, tætheden af kulstof nanorør er lille. Plasmaet fokuserer nanorørene på underlaget med høj densit
Ny metode kan afsætte nanomaterialer på fleksible overflader og 3D-objekterDysen affyrer en stråle af kulstofnanorør med heliumplasma slukket og tændt. Når plasmaet er slukket, tætheden af kulstof nanorør er lille. Plasmaet fokuserer nanorørene på underlaget med høj densit -
 Grønt lys til ultrafine displayfarverETH kemiske ingeniører har produceret den reneste grønne med en lysemitterende diode. Dette er gode nyheder for tv -skærme. Kredit:Sudhir Kumar / ETH Zürich Kemiske ingeniører fra ETH Zürich er ly
Grønt lys til ultrafine displayfarverETH kemiske ingeniører har produceret den reneste grønne med en lysemitterende diode. Dette er gode nyheder for tv -skærme. Kredit:Sudhir Kumar / ETH Zürich Kemiske ingeniører fra ETH Zürich er ly -
 Med kemisk modifikation, stabile RNA-nanopartikler går 3-DPeixuan Guo, PhD, Dane og Mary Louise Miller begavet stol i biomedicinsk teknik med studerende i sit laboratorium på Vontz Center for Molecular Studies (PhysOrg.com) -- I årevis, RNA har virket so
Med kemisk modifikation, stabile RNA-nanopartikler går 3-DPeixuan Guo, PhD, Dane og Mary Louise Miller begavet stol i biomedicinsk teknik med studerende i sit laboratorium på Vontz Center for Molecular Studies (PhysOrg.com) -- I årevis, RNA har virket so -
 Nanostruktureret germanium til bærbare solceller og batterielektroderFyldt med egnede organiske polymerer bliver den meget porøse germanium nanofilm en hybrid solcelle. Fordi germanium nanostrukturen danner en omvendt opalstruktur, materialet skinner som opal. Kredit:A
Nanostruktureret germanium til bærbare solceller og batterielektroderFyldt med egnede organiske polymerer bliver den meget porøse germanium nanofilm en hybrid solcelle. Fordi germanium nanostrukturen danner en omvendt opalstruktur, materialet skinner som opal. Kredit:A
- Pulsdrevet robot:Bevægelse via solitære bølger
- Det Røde Hav er ikke længere et babyhav
- LED'er lyser vejen til coronavirus-desinfektion
- Nyt mikroskop skaber nær-realtidsvideoer af processer i nanoskala
- Forskere udfører kemisk undersøgelse af en gammel, metalrig kuglehob
- En ny regulator for vesikelhandel med planter


