Epirubicin-ladet nanomedicin slår immunkontrolpunktblokaderesistens i glioblastom
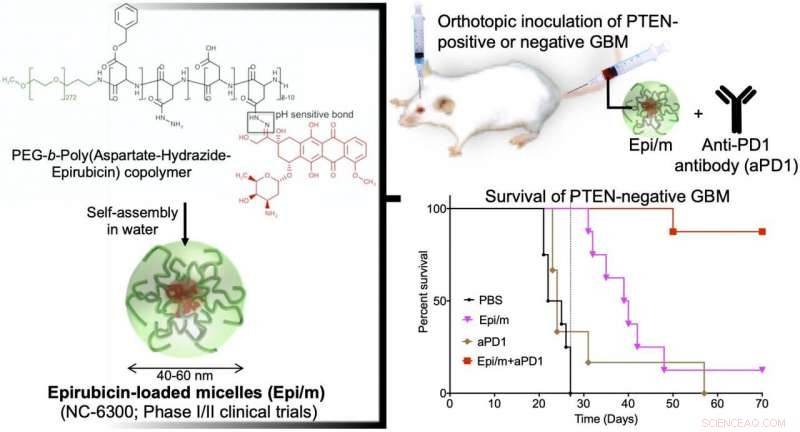
Til venstre:Hydrofobt epirubisin er konjugeret til den ene ende af hydrofil polyethylenglycol (PEG) kæde med aspartat-hydrazid som en linker. I vand, dette molekyle er selvsamlet til dannelse af nano-miceller (Epi/m). Øverst til højre:PTEN(+) eller PTEN(-) GBM blev transplanteret ind i hjernen på mus, og Epi/m og anti-PD1-antistof (aPD1) blev administreret gennem halevenen for at evaluere overlevelsesperioden. Nederst til højre:Sammenligning af overlevelsesperiode i tilfælde af PTEN(-)GBM. PBS (phosphatbufferopløsning) blev administreret til kontrolgruppen. Som resultat, ingen af kontrolgruppen (sort) kunne overleve mere end 30 dage (8/8). Epi/m alene gruppe (lyserød) døde gradvist efter 30 dage, halvdelen (4/8) på 40 dage, og 7/8 gange 50 dage. aPD1 alene (brun) dræbte 6/7 inden for 30 dage. I modsætning, ved hjælp af Epi/m+aPD1 (rød), 1/8 døde 50 dage senere, men 7/8 var i live efter 3 måneder endda. Kredit:2020 Innovation Center of NanoMedicine
En nanomedicin-baseret strategi for kemo-immunterapi (CIT) af glioblastom (GBM), som har den værste prognose blandt hjernetumorer, blev udviklet med succes. In vivo-eksperimenter viste, at den kombinerede brug af epirubicin-indkapslende nano-miceller (Epi/m) med immun checkpoint-hæmmere (ICI) udryddede PTEN-negativ GBM, som er meget modstandsdygtig overfor ICI alene. På grund af de synergistiske virkninger af Epi/m plus ICI kombination, antallet af tumorinfiltrerende T-celler (TIL) og andre antitumorimmunceller steg signifikant for at dræbe kræftceller effektivt.
På den anden side, intratumorale knoglemarvs-afledte immunsuppressive celler (MDSC), som forstyrrer immunresponset, blev væsentligt reduceret. CIT gav også robuste immunologiske hukommelseseffekter mod tumorerne, som effektivt afviste nyligt implanterede PTEN-negative GBM-celler i hjernen. Mens fri epirubicin kan forårsage skade på organer, herunder især hæmatopoietiske organer, vores nanomedicinske strategi reducerede disse bivirkninger markant, forbedring af immunresponset. Epi/m er allerede avanceret til kliniske forsøg for andre kræfttyper, og denne CIT-strategi kan forventes at blive oversat til klinisk evaluering i fremtiden. Disse resultater er offentliggjort i ACS Nano den 6. august af American Chemical Society.
Innovationscenteret for nanomedicin (direktør:Prof. Kazunori Kataoka, Sted:Kawasaki-City, Forkortelse:iCONM) annoncerede, at en ny terapeutisk mulighed for glioblastom (GBM) blev påvist i mus, i en samarbejdsundersøgelse med Institut for Bioteknik, Ingeniørskolen, Universitetet i Tokyo. GBM er en hjernetumor med ekstrem hurtig progression og dårlig prognose (5-års overlevelsesrate:10,1%). Selvom flere forbindelser evalueres i kliniske undersøgelser, der er ingen terapeutisk mulighed for væsentligt at forbedre overlevelsesperioden. I særdeleshed, patienter med abnormiteter i PTEN-genet, et af kræftundertrykkende gener, er meget modstandsdygtige over for aktuelt tilgængelige behandlinger og har høje medicinske behov.
Generelt, immun checkpoint inhibitors (ICI'er) anses for at være ineffektive mod GBM, da GBM er immunsuppressiv med lav T-celleinfiltration. I metoden præsenteret i dette papir, iCONMs nano-lægemiddelleveringsteknologi muliggør selektiv tumorakkumulering af epirubicin, som forårsager immunogen celledød (ICD), til tumorvæv, derved, forårsager ICD lokalt til synergisering med ICI. Som resultat, denne nanomedicin-baserede kemo-immunterapi (CIT) var effektiv i mus transplanteret med GBM i hjernen (i det følgende benævnt muse-GBM-model), og lykkedes med at forlænge musenes overlevelse betydeligt. Kombinationen af de epirubicin-ladede nano-miceller-behandlede mus viste høj infiltration af cytotoksiske T-celler (TIL) og nedsatte knoglemarvs-afledte immunsuppressive celler (MDSC). Til sidst blev undertrykkelse af immunkontrolpunktets funktion observeret.
Mutationer i PTEN-genet forekommer hyppigt i GBM, resulterer i immunsuppressive veje, der fremmer modstanden mod ICI'er. Dermed, mens ICI'er udryddede 40% af tumorerne i en muse-GBM-model, hvor PTEN-genet er normalt, i en model, hvor PTEN-genet blev slået ud, ICI'er var ikke i stand til at forlænge musenes overlevelse. På celleniveau, det blev fundet, at PTEN-deficiente celler (CT2A-luc) udtrykte ca. 5 gange mere PDL1 end normale celler, hvilket sandsynligvis hænger sammen med den terapeutiske resistens med ICI. Da epirubicin har vist evnen til at undertrykke PDL1-ekspression i tumorer, såsom brystkræft, det ville være muligt at reducere PDL1-niveauer af GBM, hvis tilstrækkelig mængde epirubicin kan afgives til GBM-læsioner. Dermed, CIT ved hjælp af nanomiceller indeholdende epirubicin (Epi/m) i kombination af ICI blev brugt til at øge antitumoreffektiviteten mod GBM.
I en GBM-model med normalt PTEN-udtryk (GL261-luc), Epi/m (5 mg/kg på Epi-basis) plus anti-PD1-antistoffer (5 mg/kg) resulterede i overlevelse af alle mus i mere end 70 dage, med en bemærkelsesværdig forlængelse af overlevelsestiden. I denne model, PBS-behandlede mus døde inden for 30 dage, mus behandlet med anti-PD1-antistoffer alene (5 mg/kg) gav 40 % af musene mulighed for at overleve i mindst 70 dage, og Epi/m (5 mg/kg Epi-basis) resulterede i 80 % af musenes overlevelse i mere end 70 dage. I modsætning, i den PTEN-mangelfulde model (CT2A-luc), Epi/m (5 mg/kg på Epi-basis) plus anti-PD1-antistoffer (5 mg/kg) resulterede i kun 30 % af musenes overlevelse i mere end 70 dage, og ingen klar overlevelseseffekt kunne bekræftes for de andre kontrolgrupper. Når dosis blev øget til 15 mg/kg Epi/m (i Epi-basis) og kombineret med anti-PD1-antistoffer (5 mg/kg), 90 % af musene var i stand til at overleve i mere end 70 dage, bemærkelsesværdig forlængelse af muses overlevelse.
 Varme artikler
Varme artikler
-
 ORNL fund går ud over overfladen af oxidfilmDenne figur viser den spektroskopiske måling (strøm som funktion af spænding) og dette som funktion af temperatur. Gengivet med tilladelse fra The Royal Society of Chemistry (Phys.org) —Bedre batt
ORNL fund går ud over overfladen af oxidfilmDenne figur viser den spektroskopiske måling (strøm som funktion af spænding) og dette som funktion af temperatur. Gengivet med tilladelse fra The Royal Society of Chemistry (Phys.org) —Bedre batt -
 Forskere udvikler nye rammer for nanoantenna lysabsorberingQinglan og Cunningham fandt en måde at bruge nanoantenna -teknologi til at høste lys. Kredit:Micro and Nanotechnology Laboratory, University of Illinois i Urbana-Champaign At udnytte lysets energi
Forskere udvikler nye rammer for nanoantenna lysabsorberingQinglan og Cunningham fandt en måde at bruge nanoantenna -teknologi til at høste lys. Kredit:Micro and Nanotechnology Laboratory, University of Illinois i Urbana-Champaign At udnytte lysets energi -
 Bygget til hastighed:DNA-nanomaskiner tager et (hurtigt) skridt fremadGennem en proces kendt som strengforskydning, en lillebitte gåanordning, der består af DNA, bevæger sig hen over en overflade i en rullende bevægelse. Den nye enhed udførte denne bedrift hurtigere end
Bygget til hastighed:DNA-nanomaskiner tager et (hurtigt) skridt fremadGennem en proces kendt som strengforskydning, en lillebitte gåanordning, der består af DNA, bevæger sig hen over en overflade i en rullende bevægelse. Den nye enhed udførte denne bedrift hurtigere end -
 Jernstegstenene til bedre bærbar teknologi uden halvledereJern-prikkede bornitrid nanorør, lavet i Yoke Khin Yaps laboratorium ved Michigan Tech, kunne skabe bedre bærbar teknologi på grund af deres fleksibilitet og elektroniske adfærd. Kredit:Michigan Tech,
Jernstegstenene til bedre bærbar teknologi uden halvledereJern-prikkede bornitrid nanorør, lavet i Yoke Khin Yaps laboratorium ved Michigan Tech, kunne skabe bedre bærbar teknologi på grund af deres fleksibilitet og elektroniske adfærd. Kredit:Michigan Tech,
- Alt, der glimter, er ikke guld:Misbrug af kunstig intelligens af stor teknologi kan skade udviklings…
- Første generations universitetsstuderende har brug for mere vejledning til at navigere i uddannelse…
- To SwRI-eksperimenter flyver ombord på Blue Origins nye Shepard suborbitale raket
- Orkanen Delta svækkes, da den er på vej mod Mexico
- Italiensk resort evakueret på grund af risiko for faldende Mont Blanc-is
- Præsident Trumps Nye Det Hvide Hus Klimapanel Indeholder en Klima Denialist


