Teknologi kan øge DNA-sekventering til diagnosticering af visse DNA-mutationer

Fra venstre, postdoc Andrey Mikheykin, Ph.D., Jason Reed, Ph.D., og postdoc Sean Koebley, Ph.D., arbejdet sammen om undersøgelsen. Kredit:John Wallace, VCU Massey Cancer Center
Læger bruger i stigende grad genetiske signaturer til at diagnosticere sygdomme og bestemme det bedste behandlingsforløb, men at bruge DNA-sekventering og andre teknikker til at detektere genomiske omlejringer forbliver dyrt eller begrænset i muligheder. Imidlertid, et innovativt gennembrud udviklet af forskere ved Virginia Commonwealth University Massey Cancer Center og VCU Department of Physics lover at diagnosticere DNA-omlejringsmutationer til en brøkdel af prisen med forbedret nøjagtighed.
Ledet af VCU-fysiker Jason Reed, Ph.D., holdet udviklede en teknik, der kombinerer en proces kaldet digital polymerasekædereaktion (dPCR) med højhastigheds atomkraftmikroskopi (HSAFM) for at skabe et billede med en opløsning i en sådan nanoskala, at brugere kan måle forskelle i længden af gener i en DNA-sekvens. Disse variationer i genlængde, kendt som polymorfier, kan være nøglen til præcis diagnosticering af mange former for kræft og neurologiske sygdomme.
En undersøgelse, der beskriver metoden, blev for nylig offentliggjort i tidsskriftet ACS Nano , og forskerholdet rapporterede deres resultater på de årlige møder for Association of Molecular Pathology og American Society of Hematology. Tidligere forskning i detaljer om HSAFM-teknologien blev beskrevet af VCU Massey Cancer Center i 2017.
"Den teknologi, der er nødvendig for at opdage DNA-sekvensomlægninger, er dyr og begrænset i tilgængelighed, Alligevel er medicin i stigende grad afhængig af den information, den giver, for præcist at diagnosticere og behandle kræftsygdomme og mange andre sygdomme, " siger Jason Reed, Ph.D., medlem af Cancer Biology forskningsprogrammet ved VCU Massey Cancer Center og lektor i Institut for Fysik på VCU College of Humanities and Sciences. "Vi har udviklet et system, der kombinerer en rutinemæssig laboratorieproces med et billigt, men kraftigt atommikroskop, der giver mange fordele i forhold til standard DNA-sekventering til denne applikation, til en brøkdel af prisen."
dPCR bruger DNA-polymerase-enzymet til eksponentielt at klone prøver af DNA eller RNA til yderligere eksperimenter eller analyse. Prøven placeres derefter på en atomisk flad plade til inspektion ved hjælp af HSAFM, som trækker en ekstremt skarp mikroskopisk stylus svarende til nålen på en pladespiller hen over prøven for at skabe præcise målinger på molekylært niveau. Teknikken blev tilpasset af Reeds team til at bruge optiske lasere, som dem i en dvd-afspiller, at behandle prøver med en hastighed tusindvis af gange hurtigere end typisk atomkraftmikroskopi. Forskerne udviklede derefter computerkode til at spore længden af hvert DNA-molekyle.
Holdet hævder, at hver dPCR-reaktion koster mindre end $1 at scanne ved hjælp af deres teknik.
For at demonstrere den kliniske nytte af processen, Reed samarbejdede med Amir Toor, M.D., hæmatolog-onkolog og medlem af forskningsprogrammet Developmental Therapeutics i Massey, og Alden Chesney, M.D., lektor i patologi på Patologisk Institut ved VCU School of Medicine. Sammen, de sammenlignede Reeds teknik med den nuværende standardtest til diagnosticering af DNA-længdepolymorfismer i FLT3-genet hos patienter med akut myeloid leukæmi. Patienter med disse mutationer har typisk en mere aggressiv sygdom og dårlig prognose sammenlignet med patienter uden mutationen.
Reeds teknik identificerede nøjagtigt FLT3-genmutationer i alle prøver og matchede resultaterne af den nuværende guldstandardtest (LeukoStrat CDx FLT3 Mutation Assay) ved måling af længderne af gensegmenterne. Imidlertid, i modsætning til den nuværende test, Reeds analyse rapporterer også variant allelfraktionen (VAF). VAF kan vise, om mutationen er nedarvet, og tillader påvisning af mutationer, der potentielt kan gå glip af den aktuelle test.
"Vi valgte at fokusere på FLT3-mutationer, fordi de er svære at diagnosticere, og standardanalysen er begrænset i kapacitet, " siger Reed. "Vi planlægger at fortsætte med at udvikle og teste denne teknologi i andre sygdomme, der involverer DNA-strukturelle mutationer. Vi håber, det kan være et kraftfuldt og omkostningseffektivt værktøj for læger over hele verden, der behandler kræft og andre ødelæggende sygdomme drevet af DNA-mutationer."
 Varme artikler
Varme artikler
-
 Enkelte umærkede biomolekyler kan detekteres gennem lysFølsom over for enkeltpartikler:En glasmikrosfære og guld nanotråd monteret på den forstærker lyset så kraftigt, at det er muligt at påvise enkelte DNA-fragmenter. DNA-fragmenterne binder til fragment
Enkelte umærkede biomolekyler kan detekteres gennem lysFølsom over for enkeltpartikler:En glasmikrosfære og guld nanotråd monteret på den forstærker lyset så kraftigt, at det er muligt at påvise enkelte DNA-fragmenter. DNA-fragmenterne binder til fragment -
 Klem hver dråbe ferskvand fra spildevandslagenVarme saltlage, der bruges i traditionelle membrandestillationssystemer, er stærkt ætsende, gør varmevekslerne og andre systemelementer dyre, og begrænsning af vandindvinding (a). For at forbedre dett
Klem hver dråbe ferskvand fra spildevandslagenVarme saltlage, der bruges i traditionelle membrandestillationssystemer, er stærkt ætsende, gør varmevekslerne og andre systemelementer dyre, og begrænsning af vandindvinding (a). For at forbedre dett -
 Termisk syn:Grafen lysdetektor først til at spænde over infrarødt spektrumKredit:University of Manchester Den første rumtemperatur-lysdetektor, der kan registrere det fulde infrarøde spektrum, har potentialet til at sætte varmesynsteknologi ind i en kontaktlinse. I mod
Termisk syn:Grafen lysdetektor først til at spænde over infrarødt spektrumKredit:University of Manchester Den første rumtemperatur-lysdetektor, der kan registrere det fulde infrarøde spektrum, har potentialet til at sætte varmesynsteknologi ind i en kontaktlinse. I mod -
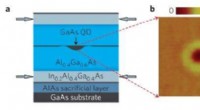 Kvanteprikker med lukkede lyshuller kunne have anvendelser i kvanteteknologier(a) Kvantepriklaget er i midten af en forspændt membran. En induceret trækbelastning på kvanteprikkerne flytter prikkernes karakter fra dominerende tungt hul til dominerende let hul. (b) Atomkraftmi
Kvanteprikker med lukkede lyshuller kunne have anvendelser i kvanteteknologier(a) Kvantepriklaget er i midten af en forspændt membran. En induceret trækbelastning på kvanteprikkerne flytter prikkernes karakter fra dominerende tungt hul til dominerende let hul. (b) Atomkraftmi
- Rejs til Big Bang gennem lithium fra en Mælkevejsstjerne
- Forskning tester, hvilket nanosystem der fungerer bedst til kræftbehandling
- En blomsterbestøvningsalgoritme til effektiv planlægning af robotstier
- At holde tungmetaller ude af øl og vin
- Vurdering af fordele og risici ved landbaseret fjernelse af drivhusgasser
- Nyt online værktøj hjælper bedre med at tjene miljømæssig retfærdighed


