Tatovering lavet af guld nanopartikler revolutionerer medicinsk diagnostik
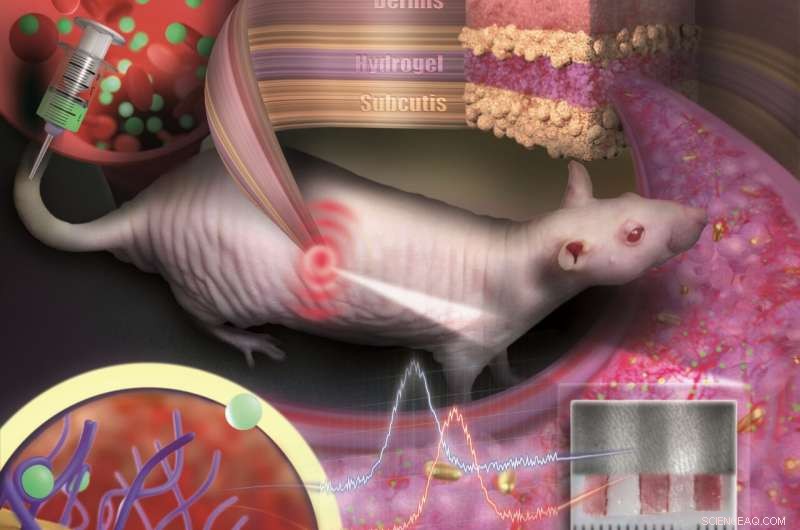
Guld nanopartikler indlejret i en porøs hydrogel kan implanteres under huden og bruges som medicinske sensorer. Sensoren er som en usynlig tatovering, der afslører koncentrationsændringer af stoffer i blodet ved farveændring. Kredit:Nanobiotechnology Group, JGU Kemisk Institut
Ideen om implanterbare sensorer, der kontinuerligt transmitterer information om vitale værdier og koncentrationer af stoffer eller lægemidler i kroppen, har fascineret læger og videnskabsmænd i lang tid. Sådanne sensorer muliggør konstant overvågning af sygdomsprogression og terapeutisk succes. Imidlertid, indtil nu, implanterbare sensorer har ikke været egnede til at blive permanent i kroppen og kræver udskiftning efter et par dage eller uger.
Der er også problemet med implantatafstødning, da immunsystemet genkender sensoren som et fremmedlegeme. Med mange teknologier, sensorens farve, hvilket indikerer koncentrationsændringer, er ustabil og falmer over tid. Forskere ved Johannes Gutenberg University Mainz (JGU) har udviklet en ny type implanterbar sensor, der kan implanteres i kroppen i flere måneder. Sensoren er baseret på farvestabile guld-nanopartikler, der er modificeret med receptorer for specifikke molekyler. Indlejret i et kunstigt polymert væv, nanogolden er implanteret under huden, hvor den rapporterer ændringer i lægemiddelkoncentrationer ved at ændre dens farve.
Professor Carsten Soennichsens forskningsgruppe ved JGU har i mange år brugt guldnanopartikler som sensorer til at detektere små mængder proteiner i mikroskopiske flowceller. Guldnanopartikler fungerer som små antenner for lys:De absorberer og spreder det kraftigt, og fremstår farverige. De reagerer på ændringer i deres omgivelser ved at skifte farve. Soennichsens team har udnyttet dette koncept til implanteret medicinsk sensing.
For at forhindre de små partikler i at spredes eller nedbrydes af immunceller, de er indlejret i en porøs hydrogel med en vævslignende konsistens. Når først implanteret under huden, små blodkar og celler vokser ind i porerne. Sensoren er integreret i vævet og afstødes ikke som et fremmedlegeme. "Vores sensor er som en usynlig tatovering, ikke meget større end en øre og tyndere end en millimeter, sagde professor Carsten Soennichsen, leder af Nanobioteknologigruppen på JGU. Da guld-nanopartiklerne reflekteres i den infrarøde bølgelængde, de er ikke synlige for øjet. Imidlertid, en speciel slags måleenhed kan registrere deres farve non-invasivt gennem huden.
I deres undersøgelse offentliggjort i Nano bogstaver , JGU-forskerne implanterede deres guld-nanopartikelsensorer under huden på hårløse rotter. Farveændringer i disse sensorer blev overvåget efter administration af forskellige doser af et antibiotikum. Lægemiddelmolekylerne blev transporteret til sensoren via blodbanen. Ved at binde sig til specifikke receptorer på overfladen af guldnanopartiklerne, de fremkalder farveændring, der er afhængig af lægemiddelkoncentrationen. Takket være de farvestabile guld-nanopartikler og den vævsintegrerende hydrogel, sensoren viste sig at forblive mekanisk og optisk stabil over flere måneder.
"Vi er vant til, at farvede genstande bleges over tid. Guld nanopartikler, imidlertid, må ikke bleges, men beholder deres farve permanent. Da de let kan belægges med forskellige receptorer, de er en ideel platform til implanterbare sensorer, " forklarede Dr. Katharina Kaefer, første forfatter til undersøgelsen.
Det nye koncept er generaliserbart og har potentiale til at forlænge levetiden for implanterbare sensorer. I fremtiden, guld nanopartikel-baserede implanterbare sensorer kunne bruges til at observere koncentrationer af biomarkører eller lægemidler i kroppen samtidigt. Sådanne sensorer kan finde anvendelse i lægemiddeludvikling, medicinsk forskning eller personlig medicin, såsom behandling af kroniske sygdomme.
Soennichsen havde ideen om at bruge guld nanopartikler som implanterede sensorer i 2004, da han startede sin forskning i biofysisk kemi som juniorprofessor i Mainz. Imidlertid, projektet blev først realiseret 10 år senere i samarbejde med Dr. Thies Schroeder og Dr. Katharina Kaefer, begge forskere ved JGU. Schroeder var erfaren i biologisk forskning og forsøgsdyrsvidenskab og havde allerede gennemført flere års forskningsarbejde i U.S.A.
Kaefer ledte efter et spændende emne til sin doktorgrad og var især interesseret i projektets komplekse og tværfaglige karakter. De første resultater førte til et stipendium tildelt Kaefer af Max Planck Graduate Center (MPGC) samt økonomisk støtte fra Stiftung Rheinland-Pfalz für Innovation. "Sådan et projekt kræver mange mennesker med forskellig videnskabelig baggrund. Trin for skridt, vi var i stand til at overbevise flere og flere mennesker om vores idé, sagde Soennichsen. Til sidst, det var tværfagligt teamwork, der resulterede i den succesfulde udvikling af den første funktionelle implanterede sensor med guld nanopartikler.
 Varme artikler
Varme artikler
-
 Brandalarm tapet registrerer, modstår, og advarer om husbrandeBrandsikkert tapet tåler flammer, mens en termosensitiv sensor udløser en alarm om lyd og lys. Kredit:Chen et al. © 2018 American Chemical Society Forskere har designet et brandalarmtapet lavet af
Brandalarm tapet registrerer, modstår, og advarer om husbrandeBrandsikkert tapet tåler flammer, mens en termosensitiv sensor udløser en alarm om lyd og lys. Kredit:Chen et al. © 2018 American Chemical Society Forskere har designet et brandalarmtapet lavet af -
 Ny algoritme kan opdage materialer med usædvanlige egenskaber – inklusive usynlighedMed denne algoritme, vi kan designe nye metamaterialeegenskaber efter behov, sagde Liu, en adjunkt i maskin- og industriteknik. Kredit:Adam Glanzman/Northeastern University Metamaterialer er kuns
Ny algoritme kan opdage materialer med usædvanlige egenskaber – inklusive usynlighedMed denne algoritme, vi kan designe nye metamaterialeegenskaber efter behov, sagde Liu, en adjunkt i maskin- og industriteknik. Kredit:Adam Glanzman/Northeastern University Metamaterialer er kuns -
 Forskere viser, at laserinduceret grafen dræber bakterier, modstår biofoulingI den øverste række, væksten af biofilm på overflader med en opløsning indeholdende Pseudomonas aeruginosa observeres på, fra venstre, polyimid, grafit og laser-inducerede grafen overflader. Grøn, r
Forskere viser, at laserinduceret grafen dræber bakterier, modstår biofoulingI den øverste række, væksten af biofilm på overflader med en opløsning indeholdende Pseudomonas aeruginosa observeres på, fra venstre, polyimid, grafit og laser-inducerede grafen overflader. Grøn, r -
 Gammelt blæk til kræftbehandlingKredit:American Chemical Society I hundreder af år, Kinesiske kalligrafer har brugt et plantebaseret blæk til at skabe smukke budskaber og kunst. Nu, en gruppe melder sig ind ACS Omega at dette
Gammelt blæk til kræftbehandlingKredit:American Chemical Society I hundreder af år, Kinesiske kalligrafer har brugt et plantebaseret blæk til at skabe smukke budskaber og kunst. Nu, en gruppe melder sig ind ACS Omega at dette
- Antarktis ishylde risikerer at kollapse på grund af varme bjergvind
- Kina åbner en mega-bro, der forbinder Hong Kong med fastlandet
- Sådan beregnes vertikal overdrivelse
- I Sibiriens skove, klimaforandringer sætter gang i zombiebrande
- De værste former for hjemløshed er mindre almindelige i Skotland end i England
- Nogle træer kan ikke overleve havniveaustigninger


