Guld nanopartikler injiceret i tumorer kan forbedre strålebehandlingen af kræft
Den begrænsende faktor i cancerstrålebehandling er, at doser høje nok til at forsøge at helbrede tumorer også skader omkringliggende normalt væv. Kredit:Shutterstock
Kræft er den næststørste dødsårsag på verdensplan. I 2018, der var 18,1 millioner nye tilfælde og 9,5 millioner kræftrelaterede dødsfald på verdensplan. I 2040, antallet af nye kræfttilfælde om året forventes at stige til 29,5 millioner og antallet af kræftrelaterede dødsfald til 16,4 millioner.
Cirka 50 procent af alle kræftpatienter kan have gavn af strålebehandling i behandlingen af deres sygdom. Omkring halvdelen af disse patienter bliver diagnosticeret tidligt nok til, at deres kræft kan helbredes. For mange kræftformer, herunder bryst, prostata, livmoderhalsen, hoved og hals, lunge- og hjernekræft, kurativ behandling omfatter strålebehandling. Imidlertid, fordi strålebehandling ødelægger sunde celler såvel som tumorceller, doser er begrænsede.
Strålebehandling, også kaldet strålebehandling, bruges alene til behandling af kræft eller sammen med andre behandlingsmuligheder såsom kemoterapi og kirurgi. Det kan også bruges til at skrumpe tumoren før operationen. I strålebehandling, tumorceller - som deler sig meget hurtigere end andre omgivende raske celler - ødelægges ved at beskadige deres DNA.
Bivirkninger begrænser stråledosis
Den begrænsende faktor ved strålebehandling er, at doser høje nok til at forsøge at helbrede højrisiko (lokalt fremskredne) ikke-metastatiske tumorer også beskadiger omkringliggende normalt væv. I øjeblikket, vi er ved grænsen af strålebehandlingsdosis, der kan gives til patienter. For yderligere at forbedre overlevelse, der er behov for nye metoder, der forbedrer strålingseffektiviteten og samtidig reducerer bivirkninger.
En måde at opnå dette på er ved at gøre tumorceller mere følsomme over for stråling, så disse celler bliver lettere beskadiget af strålebehandling. Brug af guld nanopartikler som radiosensibilisatorer har vist lovende resultater. Disse guldnanopartikler kan indføres intravenøst for at akkumulere i tumoren ved at udnytte de defekte vægge i tumorens blodkar, som har tendens til at være utætte på grund af hurtig vækst.
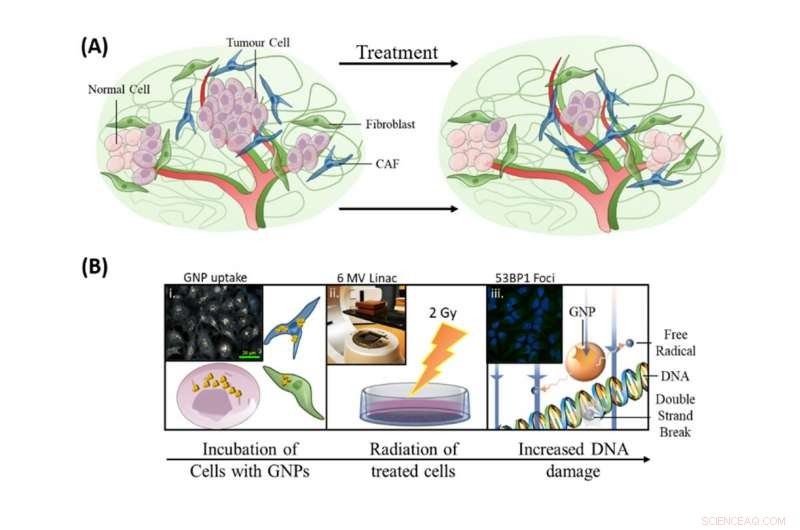
At inkorporere guldnanopartikler i de nuværende strålebehandlingsprotokoller havde tre mål:at forbedre drab af tumorceller, at målrette CAF'er og for at beskytte fibroblaster. Kredit:Bromma et al.(2020), Videnskabelige rapporter, 10, 2181., Forfatter angivet
Guldnanopartikler interagerer med røntgenfotoner, der bruges til strålebehandling, som producerer elektroner, som derefter interagerer med vandmolekyler for at producere frie radikaler. Disse frie radikaler kan beskadige celler, sænker overlevelsen af disse celler.
At forstå det komplekse biologiske system, der er til stede i og omkring tumoren, er afgørende for at optimere brugen af de radiosensibiliserende BNP'er, som skitseret af et konsortium af laboratorier, herunder vores eget nanovidenskab og teknologiudviklingslaboratorium på University of Victoria.
Målrettede interaktioner inde i tumoren
I dette arbejde, vi diskuterer vigtigheden af at undersøge, hvilke cellulære komponenter i tumormikromiljøet, der optager guldnanopartiklerne og bliver radiosensibiliserede. Vi er især interesserede i celler kaldet aktiverede fibroblaster, som er forbundet med sårheling og har antitumorogene egenskaber, hvilket betyder, at de hjælper med at bekæmpe tumorvækst.
Imidlertid, aktiverede fibroblaster kan rekrutteres af tumorcellerne, og bliver til cancerassocierede fibroblaster (CAF'er). I stedet for anti-tumorogene egenskaber, CAF'er fremmer spredning og metastasering af tumorer.
CAFs funktion understøtter ideen om, at tumorer er "sår, der ikke heler, " og målretning af CAF'er kan vise sig at være gavnligt for forbedrede kræftbehandlingsresultater.

Akkumulering af guld nanopartikler (røde) i tumormiljøet. Kredit:Bromma et al.(2020), Videnskabelige rapporter, 10, 2181., Forfatter angivet
Som illustreret på billedet ovenfor, vores forskning i at inkorporere guldnanopartikler i de nuværende strålebehandlingsprotokoller havde tre mål:at forbedre drab af tumorceller, at målrette CAF'er og for at beskytte fibroblaster.
For at radiosensibilisering skal være effektiv til at forbedre strålebehandlingen, de celler, som behandlingen er målrettet mod (dem, der er forbundet med kræftvækst) skal have høj optagelse af de radiosensibiliserende partikler, mens de gavnlige celler skal have en lav optagelse. Dette gør, at de målrettede celler lettere ødelægges af strålebehandling i doser, som patienterne kan tåle.
Disse resultater ved hjælp af 3D-tumorer dyrket i laboratoriet er meget opmuntrende. CAF'erne havde den største optagelse af guldnanopartikler pr. celle, med næsten det tredobbelte af kræftceller, mens fibroblaster havde et relativt lille antal. Dette oversatte også til en større stigning i DNA-skader i CAF'erne sammenlignet med de andre celletyper, reducere aktiviteten af CAF'erne og bremse tumorvækst.
Denne forskel i DNA-skader på grund af selektiv målretning af cancerassocierede celler over normale celler kan tillade guldnanopartikler at være et effektivt værktøj i fremtidig cancerstrålebehandling, hjælper med at minimere skader på normalt væv, samtidig med at den lokale strålebehandlingsdosis til tumoren forbedres.
Denne undersøgelse viser, at brug af guld nanopartikler som en radiosensibilisator gør det muligt at udbrede mere skade til CAF'erne, et element, der har vist sig at have stor indflydelse på udviklingen af kræft. Vi tror på, at dette arbejde vil være en byggesten mod et mere effektivt behandlingsregime i den nærmeste fremtid. At bygge en model, der nøjagtigt kan repræsentere de forskellige interaktioner, der finder sted inde i tumorens mikromiljø, er afgørende for at forbedre behandlingsresultaterne for patienter.
Denne artikel er genudgivet fra The Conversation under en Creative Commons-licens. Læs den originale artikel. 
 Varme artikler
Varme artikler
-
 Ved at begrænse transporten af elektroner og ioner, videnskabsmænd viser, at de kan ændre mater…Kredit:Pixabay/CC0 Public Domain Som krusninger i en dam, elektroner bevæger sig som bølger gennem materialer, og når de kolliderer og interagerer, de kan give anledning til nye og interessante mø
Ved at begrænse transporten af elektroner og ioner, videnskabsmænd viser, at de kan ændre mater…Kredit:Pixabay/CC0 Public Domain Som krusninger i en dam, elektroner bevæger sig som bølger gennem materialer, og når de kolliderer og interagerer, de kan give anledning til nye og interessante mø -
 Farveudskrivning ved højest mulig opløsning muliggjort ved brug af arrays af metalbelagte nanostru…Variation i poststørrelse og -afstand i metalarrayet ændrer hvilken indkommende bølgelængde af lys (rød, grøn eller blå) reflekteres tilbage. Gengivet fra Ref. 1 © 2012 K. Kumar et al. Kommerciell
Farveudskrivning ved højest mulig opløsning muliggjort ved brug af arrays af metalbelagte nanostru…Variation i poststørrelse og -afstand i metalarrayet ændrer hvilken indkommende bølgelængde af lys (rød, grøn eller blå) reflekteres tilbage. Gengivet fra Ref. 1 © 2012 K. Kumar et al. Kommerciell -
 Magnetiske nanopartikler kunne hjælpe med varmeafledningMIT-holdets eksperimentelle opsætning er afbilledet ovenfor. Kredit:MIT Kølesystemer er generelt afhængige af vand pumpet gennem rør for at fjerne uønsket varme. Nu, forskere ved MIT og i Australi
Magnetiske nanopartikler kunne hjælpe med varmeafledningMIT-holdets eksperimentelle opsætning er afbilledet ovenfor. Kredit:MIT Kølesystemer er generelt afhængige af vand pumpet gennem rør for at fjerne uønsket varme. Nu, forskere ved MIT og i Australi -
 Kommer rundt til stabil selvsamlingTeamet brugte lineære og cykliske blokcopolymerer til at skabe blomstformede miceller. De cyklisk baserede miceller modstod betydeligt højere temperaturer og saltindhold, og kunne have mange anvendels
Kommer rundt til stabil selvsamlingTeamet brugte lineære og cykliske blokcopolymerer til at skabe blomstformede miceller. De cyklisk baserede miceller modstod betydeligt højere temperaturer og saltindhold, og kunne have mange anvendels
- Hvordan man laver hoppe Putty
- Ny forskning har til formål at hjælpe med at fange børnemordere
- Arkæologer skal undgå forhistoriske Brexit-paralleller - de tilskynder til forskruede læsninger a…
- Effektivt materiale udviklet til at forhindre post-kirurgisk vedhæftning
- Forskere udvider kraften i genredigering ved at udvikle en ny klasse af DNA-base-editorer
- Netværk af lyde:Ny forskning afslører den magiske hemmelighed bag menneskelige netværk


