Brug af nanoporer til at opdage epigenetiske ændringer hurtigere
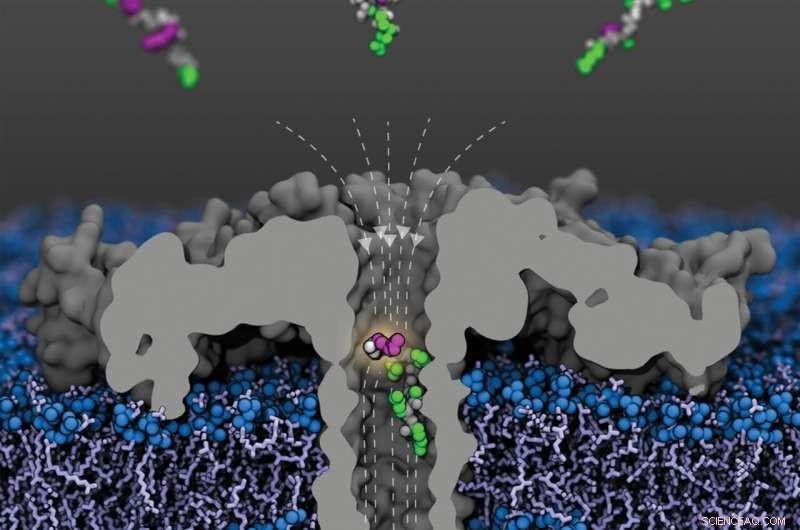
Opskåret billede af den modificerede (R220S) aerolysinpore (grå) med feltlinjer (stiplet) i en lipidmembran. Fragmenter af humant histonprotein 4 acetyleret ved forskellige lysinrester ankommer fra det øvre rum; et fragment acetyleret ved lysin-8 er vist i poren. Peptidrygraden er vist i gråt, de umodificerede sidekæder i grønt og de acetylerede lysiner i lilla. Kredit:Sarthak Kumar, University of Illinois i Urbana-Champaign
Ændringer kendt som epigenetiske modifikationer spiller en vigtig rolle i kræftudvikling. At kunne analysere dem hurtigt og pålideligt kunne bidrage væsentligt til den videre udvikling af personlig terapi. Et forskerhold fra Institut for Fysiologi ved Universitetet i Freiburg er nu lykkedes med at karakterisere de kemiske ændringer i proteiner, der er typiske for epigenetiske modifikationer ved hjælp af nanopore-analyse. Forskerne har offentliggjort deres forskningsresultater i Journal of the American Chemical Society (JACS ).
I de senere år er nanoporer blevet et bredt anvendeligt værktøj til analyse af molekyler. På grund af deres specielle egenskaber gør de det muligt at analysere molekylernes struktur inden for brøkdele af et sekund:Som cylindrisk arrangerede proteiner danner nanoporer bittesmå kanaler med kun få milliontedele millimeter (nanometer) i diameter, der kan indlejres i biomembraner.
"Til forsøgene påfører vi en konstant spænding over membranen, så ioner fra det omgivende medium strømmer gennem poren. Dette skaber en konstant, præcist målbar elektrisk strøm," forklarer prof. dr. Jan C. Behrends fra Det Medicinske Fakultet ved universitetet i Freiburg, i hvis laboratorium de nu offentliggjorte forsøg fandt sted. Men når et molekyle migrerer ind i poren, blokeres strømmen:Jo større molekylet er, jo stærkere blokeres det også.
Et protein i forskningens søgelys:H4
I forbindelse med de eksperimenter, der nu er offentliggjort, helligede Freiburg-forskerne sig undersøgelsen af det såkaldte histonprotein H4. Dette protein er fast forbundet med DNA i alle celler med en kerne og er et af de bedst undersøgte mål for epigenetiske modifikationer. En region ved den N-terminale ende af proteinet er særligt påvirket af disse modifikationer.
"Proteinsekvensen der indeholder aminosyren lysin flere gange," forklarer Behrends. Acetyl- eller methylgrupper kan f.eks. bindes til disse lysiner, som betegnes K8, K12 og K16 efter deres position i proteinkæden, som en del af epigenetiske modifikationer. Hvilken kemisk modifikation finder sted ved hvilken lysinposition er afgjort af medicinsk betydning, som Freiburg-fysiologen påpeger. "Acetylering ved K16 er for eksempel vigtig for menneskelig udvikling, mens methylering ved K12 spiller en rolle i udviklingen af nogle prostata- og lungetumorer, ifølge de seneste resultater fra Medical Center-University of Freiburg."
Detektering af ændringer ved hjælp af en nanopore
I deres eksperimenter var Behrends og hans team nu i stand til klart at skelne H4-fragmenter med eller uden acetylering, såvel som fragmenter med en, to eller tre acetyleringer. Desuden lykkedes det dem at påvise, at den nanopore, de brugte, også var følsom over for acetyleringsstedet:histonfragmenter med en acetylgruppe ved K8 blokerede strømmen gennem poren stærkere end dem, der var acetyleret ved K12, og disse igen kraftigere end dem med en K16-acetylering.
"Denne form for følsomhed er overraskende, fordi disse fragmenter er identiske med hensyn til deres masse og samlede volumen," siger Behrends. Porestrømmen ser således ud til at være følsom ikke kun for størrelsen, men også for molekylets form. Det var lige så nemt at skelne mellem de forskellige varianter af dobbeltacetylerede histonfragmenter - K8 og K12, K8 og K16, og K12 og K16 - igen på trods af den identiske masse. H4-fragmenter methyleret i forskelligt omfang og i forskellige positioner blokerede også strømmen gennem poren i forskellig grad, dog ikke så tydeligt som de acetylerede varianter.
"Vi har været i stand til at vise for første gang gennem vores eksperimenter, at nanoporeanalyse giver os mulighed for at skelne molekyler ikke kun ved deres størrelse, men også ved deres form," siger studieleder Behrends. Molekylær dynamik-simuleringer udført af forskergruppen ledet af Aleksei Aksimentiev fra University of Illinois i USA – også involveret i undersøgelsen – og viser, at et meget inhomogent elektrisk felt inde i poren spiller en nøglerolle for denne effekt.
Fremtidsvision:Optimeret medicinsk diagnostik
Mens sekventering af DNA ved hjælp af nanoporer allerede er etableret og kommercialiseret, er udviklingen af nanopore-baseret analyse af proteiner lige begyndt, siger Behrends. "Vanskeligheden ved at sekventere proteiner er, at disse er molekyler med meget uensartede ladningsmønstre." Mens DNA, som er negativt ladet, migrerer retningsbestemt i det elektriske felt og dermed kan trækkes gennem porebase for base, består proteiner af byggesten lavet af aminosyrerne med forskellige ladninger. Som følge heraf er rettet bevægelse i det elektriske felt og "scanning" af aminosyre efter aminosyre ikke mulig. Freiburg-forskerne stolede derfor på en anden tilgang til deres eksperimenter. I stedet for en pore med en kort indsnævring, som brugt i DNA-sekventering, brugte man en skræddersyet pore med en slags molekylær fælde. "Dette gjorde det muligt at fange hele proteinfragmentet på én gang," siger Behrends.
Det er endnu ikke klart, til hvilken fragmentstørrelse denne type analyse kan anvendes. Yderligere forsøg viser dog, at metoden også vil være velegnet til analyse af de H4-fragmenter, der tidligere blev brugt i epigenetisk forskning. Disse indeholder 14 aminosyrer i stedet for de ti, der er brugt her, og er i øjeblikket undersøgt for epigenetiske modifikationer med tandem massespektrometri, en meget kompliceret teknik. Forskerne håber, at nanoporerne vil gøre analysen meget enklere, hurtigere og mere omkostningseffektiv, og at den kan udføres tæt på patienten.
Videreudviklingen af nanopore-analyse af proteiner til medicinsk diagnostik og dens implementering i konkrete produkter og tjenester er også et af de centrale projekter i det nyligt godkendte BMBF Cluster4Future nanodiagBW, som Behrends leder sammen med prof. Dr. Felix von Stetten fra Hahn- Schickard-Gesellschaft, som er tovholder for dette projekt. + Udforsk yderligere
Nanoporer kan identificere aminosyrerne i proteiner, det første trin til sekventering
 Varme artikler
Varme artikler
-
 Metallisk tilstand af Ag nanoclusters i oxidativ dispersion identificeret in situDynamisk udvikling af Ag nanostrukturer under oxidativ dispersion. Kredit:DICP Oxidativ dispersion er blevet brugt i vid udstrækning til regenerering af sintrede metalkatalysatorer såvel som frems
Metallisk tilstand af Ag nanoclusters i oxidativ dispersion identificeret in situDynamisk udvikling af Ag nanostrukturer under oxidativ dispersion. Kredit:DICP Oxidativ dispersion er blevet brugt i vid udstrækning til regenerering af sintrede metalkatalysatorer såvel som frems -
 Sukkerbelagt nanorm ikke til morgenmad i det menneskelige immunsystemJern -nanopartikler injiceret før magnetisk resonansbilleddannelse kan gøre væv mere synlige, og de samme nanopartikler kan give læger mulighed for præcist at målrette tumorer med nye lægemidler. Imid
Sukkerbelagt nanorm ikke til morgenmad i det menneskelige immunsystemJern -nanopartikler injiceret før magnetisk resonansbilleddannelse kan gøre væv mere synlige, og de samme nanopartikler kan give læger mulighed for præcist at målrette tumorer med nye lægemidler. Imid -
 Næste generations enheder får et løft fra forskning i grafenDenne grafenwafer indeholder mere end 22, 000 enheder og teststrukturer. Leveret af EOC. (PhysOrg.com) - Forskere i Electro-Optics Center (EOC) Materials Division i Penn State har produceret 100 m
Næste generations enheder får et løft fra forskning i grafenDenne grafenwafer indeholder mere end 22, 000 enheder og teststrukturer. Leveret af EOC. (PhysOrg.com) - Forskere i Electro-Optics Center (EOC) Materials Division i Penn State har produceret 100 m -
 Grafenbaseret blæk kan føre til energilagringsenheder, der kan udskrives(Top) Den salt-templatede proces med at syntetisere grafen nanoark til blæk. (Bund) Blæk og trykte demonstration. Kredit:Wei et al. ©2019 American Chemical Society Forskere har lavet en blæk lavet
Grafenbaseret blæk kan føre til energilagringsenheder, der kan udskrives(Top) Den salt-templatede proces med at syntetisere grafen nanoark til blæk. (Bund) Blæk og trykte demonstration. Kredit:Wei et al. ©2019 American Chemical Society Forskere har lavet en blæk lavet
- Alt, der glimter, er ikke guld:Misbrug af kunstig intelligens af stor teknologi kan skade udviklings…
- Tyskland kræver, at leverandører af 5G-netværk skal være troværdige
- Sådan forklarer du Math Answers
- Forskere syntetiserer nyt nitrid og stabiliserer dets hexazinringe ved højt tryk
- Forskere stimulerer dannelsen af blodkar med sukker
- Hvorfor Storbritanniens kystlinje smuldrer


