Nyt system fremskynder screening af lægemiddelleverende nanopartikler

James Dahlman og Phil Santangelo. Kredit:Georgia Tech / Rob Felt
James Dahlman og Phil Santangelo er med til at definere en udviklende æra inden for medicin, hvor messenger-ribonukleinsyre - mRNA - kan leveres direkte til celler for at bekæmpe sygdom. Og deres seneste banebrydende undersøgelse kunne bane vejen for hurtigere terapeutiske opdagelser.
Længe før COVID-19-pandemien satte et globalt søgelys på mRNA-baserede vacciner, kombinerede disse to forskere i Wallace H. Coulter Department of Biomedical Engineering ved Georgia Tech og Emory University deres forskellige færdigheder for at udnytte det kliniske potentiale af mRNA.
"Vores arbejde er meget kompatibelt," sagde Dahlman, lektor og McCamish Foundation Early Career Professor. "Phils laboratorium designer og fremstiller mRNA af virkelig høj kvalitet, og mit laboratorium udvikler lipid-nanopartiklerne til at levere det."
Terapeutika fremstillet af mRNA eller DNA lover at håndtere mange sygdomme, forklarede Santangelo, professor i Coulter BME, "men de er ikke meget gode, hvis de ikke kan komme derhen, hvor de skal hen. Hvis du laver last, hvilket er Det, vi laver i mit laboratorium, har i det væsentlige brug for levering, så James og jeg har et meget naturligt samarbejde."
Deres partnerskab, som begyndte, da Dahlman ankom til Georgia Tech i 2016, giver konsekvent resultater offentliggjort i tidsskrifter med stor gennemslagskraft og opnår generøse forskningsstipendier fra føderale agenturer, herunder National Institutes of Health (NIH) og Defense Advanced Research Projects Agency (DARPA) ).
Det inkluderer en nylig strøm af banebrydende papirer:to i Nature Biomedical Engineering (fra oktober 2021 og en kommende undersøgelse) samt deres seneste publikation, udgivet 7. februar i Nature Nanotechnology.
"Vi rapporterer om et forbedret stregkodningssystem, der ville gøre dyre-prækliniske nanopartikelundersøgelser mere forudsigelige og fremskynde udviklingen af RNA-terapier," sagde Dahlman.
For adskillige år siden udviklede Dahlman og samarbejdspartnere en teknik kaldet "DNA-stregkodning", som giver mulighed for hurtig, samtidig screening af mange af hans specialfremstillede leveringskøretøjer - det der kaldes lipid-nanopartikler eller LNP'er. Forskere indsætter unikke fragmenter af DNA i forskellige LNP'er, som injiceres i mus. Genetisk sekventering bruges derefter til at bestemme, hvilke stregkoder der har nået hvilke specifikke mål.
Det nye system beskrevet i Nature Nanotechnology tager screeningsprocessen et skridt videre.
"Lipidnanopartikler udvikles normalt i mus, men når du flytter dem ind i en anden art, som en ikke-menneskelig primat - fordi det er den naturlige progression, en primat er mere som et menneske - de virker ofte ikke så godt," Santangelo sagde. "Når de ikke gør det, skal du gå tilbage og foretage justeringer."
Men hvad nu hvis du kunne strømline processen?
De gener, der påvirker LNP-levering varierer mellem prækliniske arter og mennesker, selvom omfanget af disse forskelle er ukendt, fordi undersøgelser, der sammenligner nanopartikellevering på tværs af arter, har været meget vanskelige at udføre. Indtil nu. For at fremskynde den proces udviklede forskerne et nyt testsystem, de kalder Species Agnostic Nanopartikel Delivery Screening eller SANDS.
Ved hjælp af SANDS sammenlignede holdet levering af nanopartikler samtidigt i muse-, primat- og levende menneskeceller, alt sammen inden for specielt konstruerede mus.
"Vi kan faktisk sætte den samme gruppe af nanopartikler i alle tre og sammenligne levering på tværs af arter," sagde Dahlman. "Vi fandt, hvad du kunne forvente:levering i primatcellerne forudsagde rigtig godt, hvordan leveringen i de menneskelige celler ville forløbe, mens musecellerne var mindre forudsigelige."
I modsætning til det tidligere stregkodningssystem, som fungerede godt i museceller, havde SANDS brug for en anden slags markør til screening, et molekyle kaldet reporter-mRNA. Santangelos laboratorium udviklede et, "og det kommer dybest set uden om begrænsningerne i det gamle system," sagde han. "Nu kan vi screene nye lipid-nanopartikler i mus med primat- og menneskeceller."
SANDS faciliterer allerede yderligere undersøgelser for forskerholdet.
Fremadrettet mener Dahlman og Santangelo, at en dybere forståelse af de forskellige mekanismer, der driver levering i museceller og andre celler, vil resultere i en mere effektiv udvælgelsesproces for LNP'er, hvilket gør prækliniske nanopartikelundersøgelser mere forudsigelige og accelererer udviklingen af RNA-terapier.
Den følelse af at opbygge momentum har været et slags tema for Dahlman-Santangelo-partnerskabet, siden det startede. Dahlman huskede at have interviewet hos Georgia Tech og Emory og blev straks imponeret, da han mødte Santangelo.
"Jeg forklarede ham min vision for stregkodning, og han fik den med det samme; han forklarede mig sin vision for at forbedre nyttelast, og det fik jeg straks," sagde Dahlman. "Du kunne have verdens bedste nanopartikel, men hvis du ikke putter optimeret mRNA i den, vil det ikke være noget godt."
De erkendte straks værdien og nødvendigheden af samarbejde, især fordi, som Santangelo udtrykte det, "Dette er en vildt konkurrencedygtig tid inden for mRNA-forskning."
Tempoet i deres arbejde afspejler det også. Deres oktober-studie i Nature Biomedical Engineering rapporteret udvikling af en LNP designet specifikt til at blive leveret af en forstøver til lungerne. I deres eksperimenter leverede den med succes terapeutisk mRNA og beskyttede mus mod en dødelig influenza. De har flere papirer, der nærmer sig offentliggørelse.
Og der er arbejde, der snart skal finansieres af Wellcome Leap-programmet, der inkluderer et projekt med fokus på mRNA-kodede antistoffer til lungen. De er også ved at udvikle, hvad der kunne være en anden game-changer inden for vaccinationer - hvad Santangelo beskrev som "en ny type tilgang, der har et stort potentiale:Den grundlæggende idé er at have evnen til at vaccinere mod mange patogener på én gang."
I sidste ende kommer det dog tilbage til at have det bedste køretøj til at levere den potente nyttelast; du kan ikke rigtig have det ene uden det andet. Dahlman-Santangelo forskningspartnerskabet er også komplementært på andre måder, hvor Dahlmans laboratorium udfører meget af sekventeringen, og Santangelos laboratorium udfører meget af billedbehandlingen.
"Det betyder, at vi kan skrive papirer, der er meget mere komplette," sagde Santangelo. "Det inkluderer alle data, og det kan have sekventering, det kan have billeddannelse, det har fancy laster, det har cool levering. Du sammensætter alle disse stykker, og du har en fin pakke." + Udforsk yderligere
Influenzavirusskaller kunne forbedre leveringen af mRNA til celler
 Varme artikler
Varme artikler
-
 Europæisk samarbejde kaster lys over plasmonisk forbedring af solcelleeffektivitetenScanningelektronmikrofotografi af nanostrukturerede funktioner, der er i stand til at omdirigere lyset, hvor det kan udnyttes mere effektivt. Imec, sammen med sine projektpartnere, har samarbejdet
Europæisk samarbejde kaster lys over plasmonisk forbedring af solcelleeffektivitetenScanningelektronmikrofotografi af nanostrukturerede funktioner, der er i stand til at omdirigere lyset, hvor det kan udnyttes mere effektivt. Imec, sammen med sine projektpartnere, har samarbejdet -
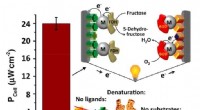 Strømproduktion opnået af en selvsamlet biobrændselscelleMaksimal effekt opnået for (i) den komplette biobrændstofopsætning, (ii) uden ligander, (iii) efter en 20-minutters varmeforbehandling, og (iv) i fravær af brændstof. Kredit:Trifonov et al. ©2019 Amer
Strømproduktion opnået af en selvsamlet biobrændselscelleMaksimal effekt opnået for (i) den komplette biobrændstofopsætning, (ii) uden ligander, (iii) efter en 20-minutters varmeforbehandling, og (iv) i fravær af brændstof. Kredit:Trifonov et al. ©2019 Amer -
 En næste generation af triboelektrisk nanogenerator (TENG) til at realisere konstant strøm fra ele…Arbejdsprincip for DC-TENG. (A) (i) Fænomen med triboelektrificeringseffekt og elektrostatisk nedbrydning (lyn) i naturen. (ii) Arbejdsmekanisme for en konventionel TENG. (B) En skematisk illustration
En næste generation af triboelektrisk nanogenerator (TENG) til at realisere konstant strøm fra ele…Arbejdsprincip for DC-TENG. (A) (i) Fænomen med triboelektrificeringseffekt og elektrostatisk nedbrydning (lyn) i naturen. (ii) Arbejdsmekanisme for en konventionel TENG. (B) En skematisk illustration -
 Forskere udvikler en metode til at observere nanokrystaldannelse ved atomopløsningStudie medforfatter Xiaoqing Pan, direktør for Irvine Materials Research Institute ved UCI, sagde, at den nye teknik til billeddannelse af omdannelsen af en precursorforbindelse indeholdende platin
Forskere udvikler en metode til at observere nanokrystaldannelse ved atomopløsningStudie medforfatter Xiaoqing Pan, direktør for Irvine Materials Research Institute ved UCI, sagde, at den nye teknik til billeddannelse af omdannelsen af en precursorforbindelse indeholdende platin
- Nyt glød-i-mørke materiale kan spore stoffers vej gennem menneskekroppen
- Afkodning af isens alder ved Mars nordpol
- Den menneskelige faktor begrænser håbet om klimaløsninger
- Over for industriel tilbagegang, Wales drømmer om Silicon Valley
- Det første private rumfartøj skyder mod månen
- Ingen ved, hvad der forårsagede en massiv eksplosion fra 1908 i Sibirien


