Billeddannelsesteknik viser nye detaljer om peptidstrukturer
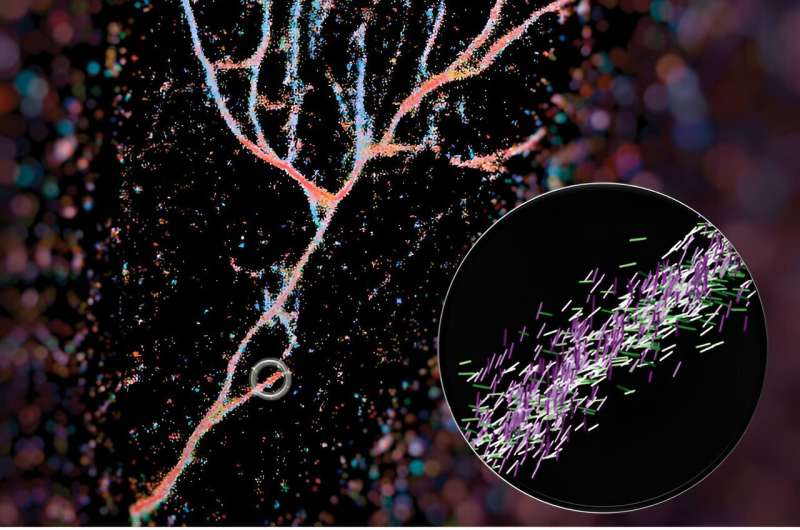
En ny billeddannelsesteknik udviklet af ingeniører ved Washington University i St. Louis kan give forskerne et meget nærmere kig på fibrilsamlinger – stakke af peptider, der inkluderer amyloid beta, især forbundet med Alzheimers sygdom.
Disse kryds-β fibril samlinger er også nyttige byggesten inden for designer biomaterialer til medicinske anvendelser, men deres lighed med deres amyloid beta fætre, hvis sammenfiltringer er et symptom på neurodegenerativ sygdom, er bekymrende. Forskere ønsker at lære, hvordan forskellige sekvenser af disse peptider er forbundet med deres varierende toksicitet og funktion for både naturligt forekommende peptider og deres syntetisk konstruerede fætre.
Nu kan videnskabsmænd få et tilstrækkeligt kig på fibrilsamlinger til at se, at der er bemærkelsesværdige forskelle i, hvordan syntetiske peptider stables sammenlignet med amyloid beta. Disse resultater stammer fra et frugtbart samarbejde mellem hovedforfatter Matthew Lew, en lektor i elektro- og systemteknik, og Jai Rudra, en lektor i biomedicinsk teknik, ved WashU's McKelvey School of Engineering.
"Vi konstruerer mikroskoper for at muliggøre bedre målinger på nanoskala, så videnskaben kan komme videre," sagde Lew.
I et papir udgivet for nylig i ACS Nano , Lew og kolleger skitserer, hvordan de brugte den røde kemiske sonde fra Nilen til at tænde kryds-β-fibriller op. Deres teknik, kaldet single-molecule orientation-localization microscopy (SMOLM), bruger lysglimt fra Nilen rød til at visualisere fiberstrukturerne dannet af syntetiske peptider og af amyloid beta.
Den nederste linje:Disse forsamlinger er meget mere komplicerede og heterogene end forventet. Det er gode nyheder, fordi det betyder, at der er mere end én måde at stable proteiner på. Med bedre målinger og billeder af fibrilsamlinger kan bioingeniører bedre forstå de regler, der dikterer, hvordan proteingrammatik påvirker toksicitet og biologisk funktion, hvilket fører til mere effektive og mindre toksiske terapier.
For det første skal videnskabsmænd se forskellen mellem dem, noget meget udfordrende på grund af den lille skala af disse forsamlinger.
"Den spiralformede snoning af disse fibre er umulig at skelne ved hjælp af et optisk mikroskop eller endda nogle superopløsningsmikroskoper, fordi disse ting bare er for små," sagde Lew.
Med højdimensionel billedteknologi udviklet i Lews laboratorium de seneste par år, er de i stand til at se forskellene.
Et typisk fluorescensmikroskop bruger fluorescerende molekyler som lyspærer til at fremhæve visse aspekter af et biologisk mål. I tilfælde af dette arbejde brugte de en af disse sonder, Nile red, som en sensor for, hvad der var omkring den. Når Nile red tilfældigt udforsker sit miljø og kolliderer med fibrillerne, udsender den lysglimt, som de kan måle for at bestemme, hvor den fluorescerende sonde er og dens orientering. Ud fra disse data kan de sammensætte det fulde billede af konstruerede fibriller, der stables meget anderledes end naturlige, såsom amyloid beta.
Deres billede af disse fibrilsamlinger lavede omslaget til ACS Nano og blev sat sammen af førsteforfatteren Weiyan Zhou, som farvekodede billedet ud fra, hvor de røde Nile pegede. Det resulterende billede er en blålig rød strømmende samling af peptider, der ligner en floddal.
Forskerne planlægger at fortsætte med at udvikle teknikker som SMOLM for at åbne nye muligheder for at studere biologiske strukturer og processer på nanoskala.
"Vi ser ting, du ikke kan se med eksisterende teknologi," sagde Lew.
Flere oplysninger: Weiyan Zhou et al., Resolving the Nanoscale Structure of β-Sheet Peptide Self-Assemblys Using Single-Molecule Orientation-Localization Microscopy, ACS Nano (2024). DOI:10.1021/acsnano.3c11771
Journaloplysninger: ACS Nano
Leveret af Washington University i St. Louis
 Varme artikler
Varme artikler
-
 Et stænk vaskemiddel gør katalytiske forbindelser mere kraftfuldeUnder højeffektmikroskopi, et pulver lavet med vaskemiddelbaseret teknologi hos Sandia National Laboratories består af perfekte kugler. Uden det, materialet ville ligne groft grus. Konsistens gør kata
Et stænk vaskemiddel gør katalytiske forbindelser mere kraftfuldeUnder højeffektmikroskopi, et pulver lavet med vaskemiddelbaseret teknologi hos Sandia National Laboratories består af perfekte kugler. Uden det, materialet ville ligne groft grus. Konsistens gør kata -
 Selvsamlende saltkrystal origamikugler i nanoskala omslutter væskerKrystalvækst ved grænsefladen af calciumpropionat-mættede vand-olie-emulsioner afhængigt af den oprindelige emulsionsstørrelse. Den oprindelige diameter af emulsionen i olie er (a) 496 μm, (b) 135 μ
Selvsamlende saltkrystal origamikugler i nanoskala omslutter væskerKrystalvækst ved grænsefladen af calciumpropionat-mættede vand-olie-emulsioner afhængigt af den oprindelige emulsionsstørrelse. Den oprindelige diameter af emulsionen i olie er (a) 496 μm, (b) 135 μ -
 Løsningen til næste generations nanochips kommer ud af den blå luftNano-gap transistorer, der opererer i luft. Når hullerne bliver mindre end den gennemsnitlige frie bane for elektroner i luft, der er ballistisk elektrontransport. Kredit:RMIT University Forskere
Løsningen til næste generations nanochips kommer ud af den blå luftNano-gap transistorer, der opererer i luft. Når hullerne bliver mindre end den gennemsnitlige frie bane for elektroner i luft, der er ballistisk elektrontransport. Kredit:RMIT University Forskere -
 Grafen er nøglen til at låse op for skabelsen af bærbare elektroniske enhederKredit:AlexanderAlUS/Wikipedia/CC BY-SA 3.0 Banebrydende forskning har med succes skabt verdens første ægte elektroniske tekstil, ved hjælp af vidundermaterialet Graphene. Et internationalt hold
Grafen er nøglen til at låse op for skabelsen af bærbare elektroniske enhederKredit:AlexanderAlUS/Wikipedia/CC BY-SA 3.0 Banebrydende forskning har med succes skabt verdens første ægte elektroniske tekstil, ved hjælp af vidundermaterialet Graphene. Et internationalt hold
- Astronauts:SpaceX Dragon-kapsel blev levende ved nedstigning
- Hvad sker der, når luften går ned på Leeward Side?
- Hvordan fortynding af ouzo spiritus kunne føre til bedre emulsioner
- Ingen forhindringer for lufthavne, der bruger satellitter
- En matematisk metode til beregning af sorte hullers egenskaber ud fra gravitationsbølgedata
- Haster forberedelser, da supertyfonen nærmer sig Filippinerne


