Nanopartikler af risklid viser lovende som et overkommeligt og målrettet anticancermiddel
Flere typer af konventionelle kræftbehandlinger, såsom strålebehandling eller kemoterapi, ødelægger sunde celler sammen med kræftceller. I fremskredne stadier af kræft kan vævstab fra behandlinger være betydeligt og endda dødeligt. Avancerede cancerterapier, der anvender nanopartikler, kan specifikt målrette mod kræftceller og skåne sundt væv.
Nylige undersøgelser har vist, at planteafledte nanopartikler (pdNP'er), der har terapeutiske virkninger, kan være et effektivt alternativ til traditionelle kræftbehandlinger. Imidlertid er ingen pdNP'er blevet godkendt som anticancer-terapeutiske midler indtil dato.
Risklid er et biprodukt, der genereres under risraffineringsprocessen, som har begrænset nytte og lav kommerciel værdi. Det indeholder dog flere forbindelser med anticancer egenskaber, såsom γ-oryzanol og γ-tocotrienol.
For at udforske disse terapeutiske egenskaber ved risklid udviklede et team af forskere ledet af professor Makiya Nishikawa fra Tokyo University of Science (TUS) i Japan nanopartikler fra risklid og testede deres effektivitet i musemodeller. Deres undersøgelse, offentliggjort i Journal of Nanobiotechnology den 16. marts 2024, var medforfatter af Dr. Daisuke Sasaki, Ms. Hinako Suzuki, lektor Kosuke Kusamori og adjunkt Shoko Itakura fra TUS.
"I de senere år er et stigende antal nye lægemiddelmodaliteter ved at blive udviklet. Samtidig er udviklingsomkostningerne forbundet med nye terapier steget dramatisk, hvilket bidrager til byrden af medicinske udgifter. For at løse dette problem brugte vi risklid, en industrielt affald med anticancer egenskaber, for at udvikle nanopartikler," forklarer prof. Nishikawa.
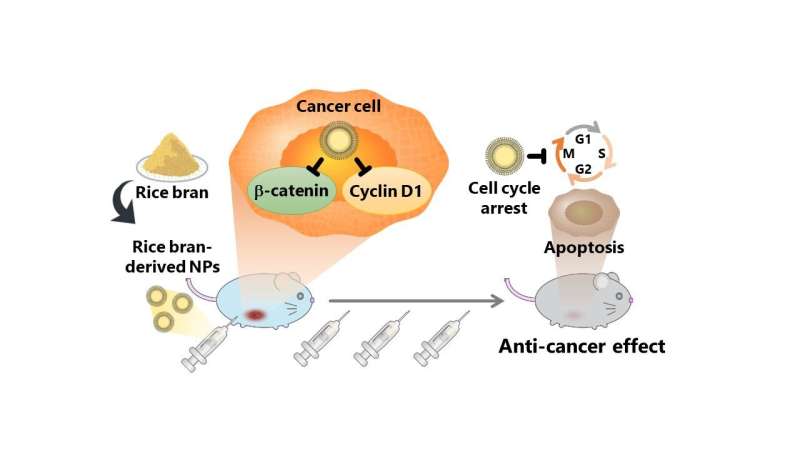
Undersøgelsen evaluerede anticancervirkningerne af risklid-afledte nanopartikler (rbNP'er), som blev opnået ved at behandle og oprense en suspension af Koshihikari risklid i vand. Når en cancercellelinje ved navn colon26 blev behandlet med rbNP'er, blev celledeling standset, og programmeret celledød blev induceret, hvilket indikerer stærke anticancer-effekter af nanopartiklerne. Den observerede anticanceraktivitet af rbNP'er kan tilskrives γ-tocotrienol og γ-oryzanol, som let optages af kræftceller, hvilket resulterer i cellecyklusstop og programmeret celledød.
Derudover reducerede rbNP'er ekspressionen af proteiner, såsom β-catenin (et protein forbundet med Wnt-signalvej involveret i celleproliferation) og cyclin D1, som er kendt for at fremme kræfttilbagefald og metastaser. Desuden reducerede rbNP'erne kun ekspressionen af β-catenin i colon26-celler uden at påvirke de ikke-kræftceller.
"En central bekymring i forbindelse med pdNP'er er deres lave farmakologiske aktivitet sammenlignet med farmaceutiske lægemidler. Imidlertid udviste rbNP'er højere anticanceraktivitet end DOXIL, en liposomal farmaceutisk formulering af doxorubicin. Derudover er doxorubicin cytotoksisk for både kræftceller og ikke-kræftceller , hvorimod rbNP'er specifikt er cytotoksiske for kræftceller, hvilket tyder på, at rbNP'er er sikrere end doxorubicin," siger prof. Nishikawa.
For at bekræfte anticanceregenskaberne af rbNP'er i den levende krop injicerede forskerne rbNP'er i mus med aggressivt adenocarcinom i deres bughule (omsluttet af mellemgulvet, mavemusklerne og bækkenet og huser organer som tarme, lever og nyrer). De observerede signifikant undertrykkelse af tumorvækst uden negative virkninger på musene. Derudover hæmmede rbNP'erne signifikant metastatisk vækst af murine melanom B16-BL6-celler i en lungemetastase-musemodel.
Risklid har flere egenskaber, der gør det til en fremragende kilde til terapeutiske pdNP'er. For det første er det økonomisk sammenlignet med mange andre kilder til pdNP'er. Næsten 40% af risklidet kasseres i Japan, hvilket giver en let tilgængelig kilde til råmateriale. For det andet er præparationseffektiviteten af rbNP'er højere end den for tidligere rapporterede pdNP'er.
Udover at være praktisk og sikker som et anticancer-terapeutisk middel, er de fysisk-kemiske egenskaber af rbNP'er meget stabile. Nogle få parametre, såsom etablering af separationsteknologier på det farmaceutiske niveau, vurdering af produktionsproceskontrolparametre og evaluering af effektivitet og sikkerhed i humane cancercellelinjer og xenograft-dyremodeller, skal undersøges forud for kliniske forsøg med mennesker.
Afslutningsvis er risklid, et landbrugsaffaldsprodukt, en kilde til terapeutiske pdNP'er, der er overkommelige, effektive og sikre og har potentialet til at revolutionere kræftbehandling i fremtiden.
"Ved at etablere en fremstillingsmetode for risklid nanopartikler med stabil kvalitet og bekræfte deres sikkerhed og effektivitet, kan vi udvikle lægemidler til kræftbehandling, der er bæredygtige, miljøvenlige og overkommelige. Derfor kan vi muligvis hjælpe flere kræftpatienter med at opretholde god fysisk og mental sundhed efter behandling," slutter prof. Nishikawa.
Flere oplysninger: Daisuke Sasaki et al., Udvikling af risklid-afledte nanopartikler med fremragende anti-cancer aktivitet og deres anvendelse til peritoneal spredning, Journal of Nanobiotechnology (2024). DOI:10.1186/s12951-024-02381-z
Leveret af Tokyo University of Science
 Varme artikler
Varme artikler
-
 SMART opdager banebrydende måde at se på overfladen af nanopartikler, accelerere nano-engineerin…Skematisk illustration af probeadsorption påvirket af en attraktiv interaktion i koronaen. Kredit:SMART Forskere fra SMART, MITs forskningsvirksomhed i Singapore, har gjort en banebrydende opdagel
SMART opdager banebrydende måde at se på overfladen af nanopartikler, accelerere nano-engineerin…Skematisk illustration af probeadsorption påvirket af en attraktiv interaktion i koronaen. Kredit:SMART Forskere fra SMART, MITs forskningsvirksomhed i Singapore, har gjort en banebrydende opdagel -
 Inspireret af en bomuldsmaskine, ingeniører satte en ny tur på at skabe små nanofibreTil venstre:Et diagram af den roterende jetspinder; øverst til højre:De resulterende spundne nanofibre; nederst til højre:Nanofibrene set ved 10um. Kredit:Kit Parker, Disease Biophysics Group på Harva
Inspireret af en bomuldsmaskine, ingeniører satte en ny tur på at skabe små nanofibreTil venstre:Et diagram af den roterende jetspinder; øverst til højre:De resulterende spundne nanofibre; nederst til højre:Nanofibrene set ved 10um. Kredit:Kit Parker, Disease Biophysics Group på Harva -
 Whirlpools på nanoskalaen kan formere magnetisk hukommelseMagnetisk transmission blød røntgenmikroskopi viser omvendt af spin-cirkularitet i magnetiske hvirvler i en række nanodisketter, efter påføring af en 1,5 nanosekund puls af magnetfelt. Ændringen fra v
Whirlpools på nanoskalaen kan formere magnetisk hukommelseMagnetisk transmission blød røntgenmikroskopi viser omvendt af spin-cirkularitet i magnetiske hvirvler i en række nanodisketter, efter påføring af en 1,5 nanosekund puls af magnetfelt. Ændringen fra v -
 Skyrmion-forskning:Fletninger af nanovortices opdagetForskere ved Jülich har opdaget strenglignende strukturer lavet af skyrmioner. Over, simulerede modeller af seks skyrmioner ved forskellige magnetiske feltstyrker; under, transmissionselektronmikrosko
Skyrmion-forskning:Fletninger af nanovortices opdagetForskere ved Jülich har opdaget strenglignende strukturer lavet af skyrmioner. Over, simulerede modeller af seks skyrmioner ved forskellige magnetiske feltstyrker; under, transmissionselektronmikrosko
- Kunne neuroteknologi gøre advokater til klogere arbejdere?
- Muslinge-inspireret lim kunne en dag gøre fosteroperation mere sikker
- Slutningen på skovrydning i den brasilianske Amazonas?
- Hvad er egenskaberne af Igneous Rocks?
- Deltidsarbejdende mødre med fleksible tidsplaner ender med at arbejde mere uden løn
- Har du brug for en bid i Seattle-Tacoma lufthavn? En robot vil nu levere mad til dig ved din gate


