Forskerhold rapporterer at observere vibrationsspektre af et enkelt protein med infrarød nanospektroskopi
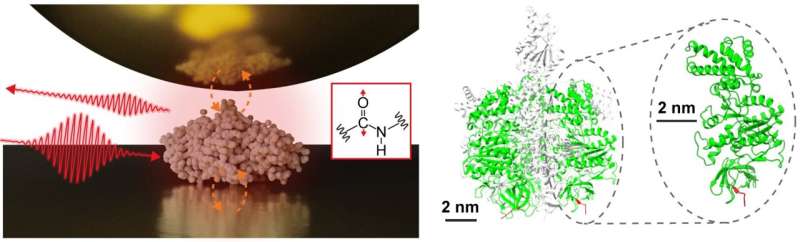
Et tværfagligt forskerhold, ledet af assisterende prof. Jun Nishida og lektor Takashi Kumagai ved Institut for Molekylær Videnskab, har med succes observeret vibrationsspektre af enkelte proteiner, bestående af cirka 500 aminosyrerester, ved hjælp af avancerede måleteknikker baseret på næsten- optisk feltmikroskopi. Denne metode anvender lys begrænset på nanometerskalaen, hvilket muliggør detaljeret analyse af ekstremt små prøver, hvilket tidligere var udfordrende med konventionel infrarød spektroskopi.
Undersøgelsen er publiceret i tidsskriftet Nano Letters .
Konventionel infrarød spektroskopi er blevet brugt i vid udstrækning til strukturel og kemisk analyse af forskellige materialer, da den kan måle vibrationsspektre, ofte omtalt som de "molekylære fingeraftryk."
Den nye præstation repræsenterer et stort fremskridt i retning af teknologiske innovationer såsom ultrafølsom og superopløsnings infrarød billeddannelse samt enkeltmolekyle vibrationsspektroskopi.
Den hurtige udvikling af nanoteknologi i de senere år har ført til stigende efterspørgsel efter ultrahøj følsomhed og superopløsning infrarød billedbehandling. Konventionel infrarød spektroskopi er imidlertid begrænset til at måle ekstremt små prøver eller opnå rumlig opløsning på nanometerskala. For eksempel kræver selv infrarød mikrospektroskopi med god følsomhed over en million proteiner for at opnå et infrarødt spektrum, hvilket gør det umuligt at måle kun et enkelt protein.
I deres undersøgelse isolerede forskerholdet et enkelt protein, en underenhed bestående af et proteinkompleks kaldet F1 -ATPase, på et guldsubstrat og udførte nærfelts infrarøde spektroskopimålinger i et omgivende miljø.
De erhvervede med succes det infrarøde vibrationsspektrum af et enkelt protein, hvilket repræsenterer et stort fremskridt, der kan føre til karakterisering af lokale strukturelle organisationer af individuelle proteiner. Sådan information er særlig vigtig for at forstå de sofistikerede funktioner af proteinkomplekser og membranproteiner, hvilket giver en dybere indsigt i deres mekanismer og interaktioner.
Desuden har de udviklet en ny teoretisk ramme, der beskriver nanoskala-interaktionerne mellem det infrarøde nærfelt og protein.
Baseret på teorien var holdet i stand til kvantitativt at reproducere de eksperimentelle vibrationsspektre, som de observerede. Disse resultater vil være uvurderlige for den kemiske analyse af biomolekyler såvel som forskellige nanomaterialer, hvilket baner vejen for en række anvendelser af infrarød spektroskopi i nanoskala.
Flere oplysninger: Jun Nishida et al., Sub-Tip-Radius Near-Field Interactions in Nano-FTIR Vibrational Spectroscopy on Single Proteins, Nano Letters (2024). DOI:10.1021/acs.nanolett.3c03479
Journaloplysninger: Nano-bogstaver
Leveret af National Institutes of Natural Sciences
 Varme artikler
Varme artikler
-
 Excitons vil forme fremtiden for elektroniske enhederKredit:EPFL Excitoner er kvasipartikler fremstillet af elektronernes exciterede tilstand og - ifølge forskning, der udføres EPFL - har potentialet til at øge energieffektiviteten af vores daglig
Excitons vil forme fremtiden for elektroniske enhederKredit:EPFL Excitoner er kvasipartikler fremstillet af elektronernes exciterede tilstand og - ifølge forskning, der udføres EPFL - har potentialet til at øge energieffektiviteten af vores daglig -
 Sporing af nanowalkers med lysEn guldcylinder med DNA-fødder kan klatre over DNA-primede bakker lavet af foldede DNA-strenge. Den anden cylinder (rød) tjener som referencepunkt for observation af nanowalker. Kredit:MPI for intelli
Sporing af nanowalkers med lysEn guldcylinder med DNA-fødder kan klatre over DNA-primede bakker lavet af foldede DNA-strenge. Den anden cylinder (rød) tjener som referencepunkt for observation af nanowalker. Kredit:MPI for intelli -
 Forskere designer energibærende partikler kaldet topologiske plexcitonerPlexcitons rejser for 20, 000 nanometer, en længde, der er i størrelsesordenen af menneskehårens bredde. Kredit:Joel Yuen-Zhou Forskere ved UC San Diego, MIT og Harvard University har konstruere
Forskere designer energibærende partikler kaldet topologiske plexcitonerPlexcitons rejser for 20, 000 nanometer, en længde, der er i størrelsesordenen af menneskehårens bredde. Kredit:Joel Yuen-Zhou Forskere ved UC San Diego, MIT og Harvard University har konstruere -
 Forskere skaber et hav af guldstjerner i nanostørrelseKonceptuelt billede overlejret på guld nanostjerner-forskningsbillede. Kredit:Timothy Holland | Pacific Northwest National Laboratory Forskere fra Department of Energys Pacific Northwest National L
Forskere skaber et hav af guldstjerner i nanostørrelseKonceptuelt billede overlejret på guld nanostjerner-forskningsbillede. Kredit:Timothy Holland | Pacific Northwest National Laboratory Forskere fra Department of Energys Pacific Northwest National L
- Skolens wellness-centre:En innovativ reaktion på studerendes stress og selvmord
- Heads Up Stargazers! To kometer passerer tæt på jorden i september
- Hvordan vejer du en stjerne? Masser af RR Lyrae-stjerner afsløret gennem deres pulseringer
- Forskere kombinerer fotoakustisk og fluorescensbilleddannelse i en lille pakke
- Isolering af intakte bakterier fra blod ved hjælp af en mikrofluidisk monolitanordning
- Forskere skaber helelektrisk spintronik


