Forskere introducerer singlet iltbatteri til bekæmpelse af multiresistente patogener
I antibakteriel fotodynamisk terapi bruges bestråling til at producere reaktive iltarter, der dræber bakterier. Fordi den kræver eksternt lys og ilt, er denne metode kun egnet til overfladeinfektioner.
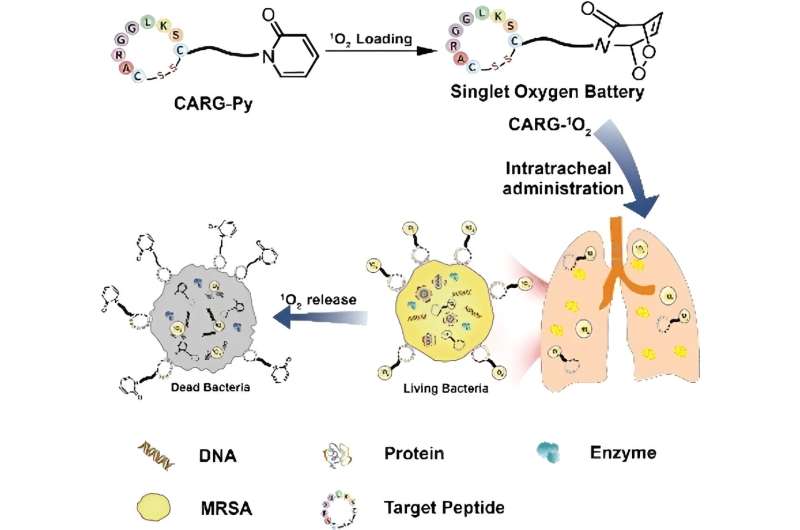
I tidsskriftet Angewandte Chemie , har et kinesisk forskerhold nu introduceret et molekylært "singlet oxygenbatteri", der kan "oplades" med reaktivt oxygen, som det derefter frigiver i dybe vævslag for at målrette mod methicillin-resistente stafylokokker.
Antibiotika-resistente bakterier er i fremmarch. Selvom de ofte er ufarlige for raske mennesker, bruger frygtede multiresistente "hospitalpatogener" såsom methicillin-resistente Staphylococcus aureus (MRSA) skader eller friske operationssår for at få adgang til kroppen. De inficerer også immunkompromitterede patienter. Fordi antibiotika ikke er effektive, er der nogle gange ikke noget middel.
Et meget lovende alternativ er antibakteriel fotodynamisk terapi, som allerede er meget udbredt i tandplejen. I denne teknik bliver et lysaktiveret stof (fotosensibilisator) bestrålet, hvilket udløser en fotodynamisk reaktion, der producerer singlet oxygen ( 1 O2 ), en ophidset form for oxygen.
I modsætning til antibiotika angriber dette stof flere biomolekylære steder på bakterierne samtidigt. Den er nem at bruge, sikker, smertefri og generelt fri for bivirkninger. Desværre har det kun været nyttigt ved overfladeinfektioner, fordi det nødvendige lys kun trænger få millimeter ind i vævet. Derudover har dybere vævslag heller ikke nok ilt til effektiv behandling.
Et team ledet af Bingran Yu og Fu-Jian Xu ved Beijing University of Chemical Technology har nu udviklet en ny tilgang til fotodynamisk terapi:et "singlet oxygenbatteri", der kan bruges til at bekæmpe dybe bakterielle infektioner, fordi det hverken kræver lys eller ekstern ilt .
Omdannelsen af oxygen til reaktiv singlet-ilt gennem bestråling i nærværelse af et molekyle, der fanger lys (fotosensibilisator), sker først. "Batteriet" er "opladet" med singlet-ilten. Dette "batteri" består af en speciel nitrogenholdig, seksleddet ring af carbonatomer (pyridon), der binder singlet-ilten tæt.
Det reaktive iltmolekyle bygger bro mellem to modsatte hjørner af ringen (endoperoxid). Et peptid bundet til ringen "genkender" specifikt MRSA-bakterier, så de molekylære batterier akkumuleres omkring og i bakterierne og frigiver kontinuerligt deres singlet-ilt.
Bakterierne angribes således samtidigt på mange forskellige steder, herunder deres membran, DNA, enzymer og andre proteiner. Dette gør udvikling af resistens praktisk talt umulig. Når det blev administreret til mus gennem forstøvning, viste singlet-iltbatteriet sig at være meget effektivt til behandling af lungeinfektioner forårsaget af MRSA. Systemiske bivirkninger blev ikke observeret.
Flere oplysninger: Yiwen Zhu et al., A Targeting Singlet Oxygen Battery for Multidrug-Resistant Bacterial Deep-Tissue Infections, Angewandte Chemie International Edition (2023). DOI:10.1002/anie.202306803
Journaloplysninger: Angewandte Chemie International Edition , Angewandte Chemie
Leveret af Wiley
 Varme artikler
Varme artikler
-
 Fleksibel, semi-transparente ultratynde solcellerDette er et mikroskopfotografi af WSe2-prøver, tilsluttet elektroder. Kredit:TU Wien Der er for nylig blevet forsket meget på grafen - kulstofflager, bestående af kun et lag atomer. Det viser sig,
Fleksibel, semi-transparente ultratynde solcellerDette er et mikroskopfotografi af WSe2-prøver, tilsluttet elektroder. Kredit:TU Wien Der er for nylig blevet forsket meget på grafen - kulstofflager, bestående af kun et lag atomer. Det viser sig, -
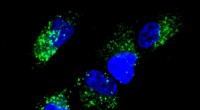 Forskere demonstrerer grundlæggende principper for nukleinsyreberegning inde i cellerBilledet viser aktivering af AND -porte i celler som observeret ved fluorescensmikroskopi. Kredit:Chiara Zurla, Georgia Tech Ved hjælp af tråde af nukleinsyre, forskere har demonstreret grundlægge
Forskere demonstrerer grundlæggende principper for nukleinsyreberegning inde i cellerBilledet viser aktivering af AND -porte i celler som observeret ved fluorescensmikroskopi. Kredit:Chiara Zurla, Georgia Tech Ved hjælp af tråde af nukleinsyre, forskere har demonstreret grundlægge -
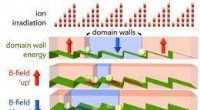 Rasle hukommelse, ny computerhukommelse takket være nanoteknologiIonbestråling skaber et asymmetrisk potentiale eller skralde for hovedvæggene (visualiseret som lysegule kugler). Bittet med en magnetisk belægning forskydes en position til venstre ved sekventielt at
Rasle hukommelse, ny computerhukommelse takket være nanoteknologiIonbestråling skaber et asymmetrisk potentiale eller skralde for hovedvæggene (visualiseret som lysegule kugler). Bittet med en magnetisk belægning forskydes en position til venstre ved sekventielt at -
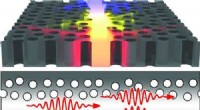 Uundgåelig lidelse, der bruges til at bygge nanolaserNanolaseren er baseret på uorden i mønsteret af huller i den fotoniske krystal. Lyskilden er indbygget i selve den fotoniske krystal, som er klar som glas og når lyset rammer et hul reflekteres det og
Uundgåelig lidelse, der bruges til at bygge nanolaserNanolaseren er baseret på uorden i mønsteret af huller i den fotoniske krystal. Lyskilden er indbygget i selve den fotoniske krystal, som er klar som glas og når lyset rammer et hul reflekteres det og


