Elektronegativitet er som en atomart tovtrækning

Kemi er overalt:I den medicin, vi tager, i teflonbelægningen på vores nonstick-pander, i cellerne i alt levende på Jorden. Og hvert grundstof i det periodiske system er en smule anderledes - dets vægt, antallet af subatomære partikler, det har, stoftilstanden, det antager, dets smeltepunkt osv., gør det unikt blandt de andre grundstoffer. En vigtig egenskab ved et atom, der bestemmer meget om, hvordan det vil slå sig sammen med andre atomer for at lave molekyler, er elektronegativitet.
Atomisk tovtrækning
"Elektronegativitet er målet for et atoms affinitet til elektroner, og det er en iboende egenskab ved hvert atom," siger Eric Ferreira, lektor i afdelingen for kemi ved University of Georgia. "Det er baseret på adskillige faktorer, der er specifikke for atomet, inklusive størrelse og antallet af protoner i kernen."
Et atoms elektronegativitet er i det væsentlige et mål for den relative sandsynlighed for, at de delte elektroner vil blive fundet tættere på det atom end et andet.
"Det fungerer ligesom to personer, der spiller tovtrækning med et reb," siger Ferreira. "Individerne er atomkernerne, og rebet er elektronerne. Hvis individerne trækker med samme styrke, så er rebet ligeligt delt. Men hvis det ene individ trækker hårdere end det andet, så vil mere af rebet begynde at samle sig på den person, der trækker hårdere. I bund og grund er den person, der trækker hårdere, mere elektronegativ og trækker reb (eller elektron) tæthed mod sig."
Du vil huske fra gymnasiets kemitime, at protonerne i et atoms kerne er positivt ladede og tiltrækker derfor negativt ladede elektroner til at kredse omkring dem. Når to atomer er bundet sammen, er en måde de klæber sammen ved at dele et par elektroner mellem dem - dette kaldes kovalent binding. Men atomerne i en kovalent binding deler muligvis ikke forældremyndigheden over elektronerne ligeligt - hvis atomer af to forskellige elementer deler elektroner i en kovalent binding, kan elektronerne bruge mere tid tættere på det ene atoms kerne end det andet. Et godt eksempel på dette er i bindingen dannet mellem et oxygenatom og to brintatomer i et vandmolekyle:Iltatomets kerne tiltrækker de delte elektroner stærkere end brinternes kerner. Derfor er oxygenatomet mere elektronegativt end brinternes — det er bedre end brinterne til at tiltrække elektronerne til dets kerne.
Hverdagselektronegativitet
Et godt eksempel på en måde, hvorpå mennesker drager fordel af elektronegativitet hver dag, er Teflon, polymeren polytetrafluorethylen (PTFE), som kan belægge en pande for at forhindre, at dine røræg klæber til den. Denne polymer er en lang kæde af carbon-på-carbon-bindinger, hvor hvert indre carbonatom også har to fluoratomer bundet til sig. Af alle grundstofferne er fluor det mest elektronegative, så bindingselektronerne holdes tæt til fluoratomerne.
Molekyler kan tiltrækkes af hinanden gennem specielle interaktioner, som Londons spredningskræfter. Disse kræfter skabes, når de konstant bevægende elektroner i et molekyle trækkes til et område af molekylet, hvilket skaber pletter i molekylet, der er mere negativt ladede og andre, der er mere positivt ladede.
I det specifikke tilfælde med Teflon, fordi fluor er så elektronegativt, minimerer kernerne i dets atomer mængden af elektronbevægelse - fluoratomet er så attraktivt for elektronerne, at de sjældent vil hænge ud omkring kulstofkernerne overhovedet. Dette betyder, at elektronbevægelsen, der ville skabe attraktive London-spredningskræfter, er ophævet, hvilket resulterer i teflons "nonstick"-egenskaber.
Elektronegativitet spiller også ind i skabelsen af lægemidler:
"Mange lægemidler er små molekyler, og de er designet til at interagere med visse proteiner i kroppen, der har specifikke funktioner," siger Ferreira. "Disse vekselvirkninger er baseret på molekylets fysiske form for præcist at passe ind i proteinets receptorform - tænk på en nøgle, der passer ind i en lås. Disse intermolekylære vekselvirkninger kan være baseret på elektrostatiske kræfter, og derfor kunne man designe lægemidler, hvor den elektroniske natur er "tunet" til specifikke atomer baseret på deres elektronegativitet for at maksimere effektiviteten af interaktionen."
Så næste gang du drikker et glas vand eller laver en grillet ostesandwich eller tager din medicin, så tak kemien for at gøre hvert element en smule anderledes - og nogle mere attraktive end andre.
Nu er det interessantBegrebet elektronegativitet blev introduceret af Linus Pauling i 1932. På Pauling-skalaen tildeles fluor en elektronegativitet på 3,98, og de andre elementer skaleres i forhold til den værdi. Jo højere værdien af elektronegativiteten er, jo stærkere tiltrækker det element de delte elektroner. Pauling og Marie Curie er de eneste to personer, der nogensinde er blevet tildelt to ikke-delte Nobelpriser i deres levetid.
 Varme artikler
Varme artikler
-
 Tilfældig tæt pakning eller fastklemning af kugler i en beholderFig1:Konfiguration af et glas med hårde kugler tæt på at sætte sig fast. Til en sammenligning, den tætpakkede struktur af den krystallinske ansigtscentrerede kubiske (FCC) konfiguration er også vist p
Tilfældig tæt pakning eller fastklemning af kugler i en beholderFig1:Konfiguration af et glas med hårde kugler tæt på at sætte sig fast. Til en sammenligning, den tætpakkede struktur af den krystallinske ansigtscentrerede kubiske (FCC) konfiguration er også vist p -
 Strainoptronics:En ny måde at styre fotoner påKunstnerisk repræsentation af en stammekonstrueret 2D-fotodetektor på fotonisk siliciumkredsløb. Kredit:George Washington University Forskere opdagede en ny måde at konstruere optoelektroniske enh
Strainoptronics:En ny måde at styre fotoner påKunstnerisk repræsentation af en stammekonstrueret 2D-fotodetektor på fotonisk siliciumkredsløb. Kredit:George Washington University Forskere opdagede en ny måde at konstruere optoelektroniske enh -
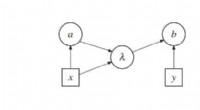 Fysikere yder støtte til retrocausal kvanteteori, hvor fremtiden påvirker fortidenKan Bell -korrelationer forklares ved retrocausale påvirkninger? Figur viser et indflydelsesdiagram, der repræsenterer de mulige årsagssygdomme i en model uden retrocausalitet. Kredit:Leifer og Pusey.
Fysikere yder støtte til retrocausal kvanteteori, hvor fremtiden påvirker fortidenKan Bell -korrelationer forklares ved retrocausale påvirkninger? Figur viser et indflydelsesdiagram, der repræsenterer de mulige årsagssygdomme i en model uden retrocausalitet. Kredit:Leifer og Pusey. -
 Frustration forklarer forskelle i superledning i molekylære ledere og kopaterFigur 1:Det molekylære arrangement af bis (ethylenedithio) tetrathiafulvalene (BEDT-TTF) laget i molekylærlederen undersøgt i denne undersøgelse (guldkugler:svovl; sølvkugler:kulstof; røde kugler:hull
Frustration forklarer forskelle i superledning i molekylære ledere og kopaterFigur 1:Det molekylære arrangement af bis (ethylenedithio) tetrathiafulvalene (BEDT-TTF) laget i molekylærlederen undersøgt i denne undersøgelse (guldkugler:svovl; sølvkugler:kulstof; røde kugler:hull
- Miljøpolitik, forurening og økonomisk vækst
- Samsung, ligesom Apple, føler sig sviende af at bremse den globale vækst
- Faktorer, der påvirker varmeledningsevnen
- Energieffektiv magnetisk RAM:En ny byggesten til spintronic-teknologier
- Næsten alle mellemskolelærere er meget stressede, undersøgelse finder
- Identifikation af kick-hastighed, der er stor nok til individuelle gravitationsbølgehændelser efte…


