Hvad forårsager dispersionskræfter?
Overvej et bægerfyldt med molekyler i en flydende tilstand. Det kan se roligt på ydersiden, men hvis du kunne se de små elektroner, der bevæger sig ind i bægeret, ville spredningskræfter være indlysende. Også kaldet London spredningskræfter, efter Fritz London, er de elektrostatiske attraktive kræfter mellem elektronerne. Hvert molekyle udviser en vis grad af disse kræfter.
TL; DR (for længe, ikke læst)
Tiltrækningen mellem nabokollektorer forårsager spredningskræfter. Elektronen skyen af et molekyle bliver tiltrukket af kernen i et andet molekyle, så fordelingen af elektroner ændrer sig og skaber en midlertidig dipol.
Hvad der forårsager dispergeringsmagter
Tiltrækningen mellem molekyler falder under kategori af Van der Waals styrker. De to typer Van der Waals kræfter er dispersionskræfter og dipol-dipolkræfter. Spredningskræfterne er svage, mens dipol-dipolstyrkerne er stærkere.
Elektronerne, som kredsløbsmolekylerne kan bevæge sig og har forskellige ladningsfordelinger over tid. Den ene ende af molekylet kan være positiv, mens den anden ende kan være negativ. En midlertidig dipol findes, når du har to modsatte ladninger, der ligger tæt på hinanden. Når et molekyle kommer i kontakt med en anden, kan det tiltrækkes af det. Elektronerne fra det første molekyle kan føle en træk mod den positive ladning af det andet molekyle, så dispersionskræfter er i aktion. Tiltrækningen er dog svag.
Eksempel på dispersionsstyrker
Ved at se på stoffer som brom (Br 2) eller dichlor (Cl 2) ses dispersionskræfterne. Et andet almindeligt eksempel er methan (CH 4). De eneste kræfter i metan er dispersionskræfter, fordi der ikke er permanente dipoler. Dispersionskræfter hjælper ikke-polære molekyler til væsker eller faste stoffer, fordi de tiltrækker partikler. Hvad forårsager en dipole-dipolkraft Når polære molekyler kommer sammen, vises dipol-dipol-kræfter. Ligesom spredningskræfter tiltrækker modsætninger igen. To molekyler bliver tiltrukket af hinanden, fordi de har permanente dipoler. Elektrostatiske interaktioner sker mellem disse dipoler. Molekylerne kan klare sig med de positive ender tiltrukket af de negative. Dipole-dipolstyrker er stærkere end spredningskræfter. Sådan bestemmes Dipole-Dipole Forces Den vigtigste måde at bestemme dipole-dipol kræfter på er at se på molekylerne og kontrollere polariteten. Du kan undersøge elektronegativitetsforskellen mellem atomer for at se om de er polære. Elektronegativitet viser atomernes evne til at tiltrække elektroner. Generelt, hvis denne forskel falder mellem 0,4 og 1,7 på elektronegativitetsskalaen, er der polaritet og en stærk chance for, at dipol-dipolkræfter eksisterer.
Sidste artikelHvilken type reaktion producerer et præcipitat?
Næste artikelHvad gør en katalysator i en kemisk reaktion?
 Varme artikler
Varme artikler
-
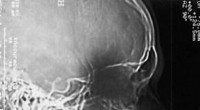 Sådan fungerer CAT -scanningeren CAT-scanningsmaskine danner en komplet tredimensionel computermodel af en patients indre krop. © iStockphoto.com/el sexeroso CAT-scanninger tager ideen om konventionel røntgenbillede til et nyt ni
Sådan fungerer CAT -scanningeren CAT-scanningsmaskine danner en komplet tredimensionel computermodel af en patients indre krop. © iStockphoto.com/el sexeroso CAT-scanninger tager ideen om konventionel røntgenbillede til et nyt ni -
 Hvad hvis en kvinde tager Viagra?Hvis du er en kvinde, der oplever seksuelle vanskeligheder, du bør konsultere en læge i stedet for at poppe den lille blå pille. Paul Bradbury/Getty Images Dette spørgsmål lyder som åbningen for endn
Hvad hvis en kvinde tager Viagra?Hvis du er en kvinde, der oplever seksuelle vanskeligheder, du bør konsultere en læge i stedet for at poppe den lille blå pille. Paul Bradbury/Getty Images Dette spørgsmål lyder som åbningen for endn -
 Jets og Rocket Flight TidslinjeDen revolutionære Boeing 367-80 rullede ud til en anerkendende skare den 14. maj, 1954. 367-80 blev brugt af Boeing som testfly i mange år, baner vejen for 707 passagerflyet og KC-135 tankskibet. Se f
Jets og Rocket Flight TidslinjeDen revolutionære Boeing 367-80 rullede ud til en anerkendende skare den 14. maj, 1954. 367-80 blev brugt af Boeing som testfly i mange år, baner vejen for 707 passagerflyet og KC-135 tankskibet. Se f -
 Fodbold med Frobenius: Super Bowl Math ProblemMed Super Bowl lige rundt om hjørnet har atleter og fans i verden deres fokus fast på det store spil. Men for _math_letes kan det store spil mindske et lille problem i relation til de mulige scoringer
Fodbold med Frobenius: Super Bowl Math ProblemMed Super Bowl lige rundt om hjørnet har atleter og fans i verden deres fokus fast på det store spil. Men for _math_letes kan det store spil mindske et lille problem i relation til de mulige scoringer


