Hvorfor producerer Lyman -overgange ultraviolette fotoner, mens balmeren synlige lysfotoner?
* Lyman Series: Disse overgange involverer elektroner, der falder fra højere energiniveau (n =2, 3, 4, ...) til jordtilstand (n =1) . Energiforskellen mellem disse niveauer er stor, hvilket resulterer i emission af højenergi ultraviolette fotoner .
* Balmer Series: Disse overgange involverer elektroner, der falder fra højere energiniveau (n =3, 4, 5, ...) til første ophidsede tilstand (n =2) . Energiforskellen mellem disse niveauer er mindre end i Lyman-serien, hvilket resulterer i emission af lavere energi synlige lysfotoner .
Her er en simpel analogi:Forestil dig en trappe med det første trin, der repræsenterer jordtilstanden (n =1) og hvert efterfølgende trin, der repræsenterer højere energiniveau.
* Lyman overgange: En elektron falder fra et højere trin (n =2, 3, 4, ...) helt ned til det første trin (n =1). Dette er en stor dråbe, der frigiver en masse energi som en ultraviolet foton.
* Balmerovergange: En elektron falder fra et højere trin (n =3, 4, 5, ...) til det andet trin (n =2). Dette er en mindre dråbe, der frigiver mindre energi som en synlig lysfoton.
Kortfattet: Energiforskellen mellem energiniveauet involveret i en overgang bestemmer energien og bølgelængden af den udsendte foton. Større energiforskelle fører til højere energi (kortere bølgelængde) fotoner som ultraviolet, mens mindre energiforskelle fører til lavere energi (længere bølgelængde) fotoner som synligt lys.
Sidste artikelHvilket himmelobjekt findes i Kuiper -bæltet?
Næste artikelHvordan genereres lys i solen?
 Varme artikler
Varme artikler
-
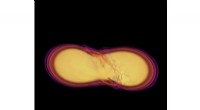 Neutronstjernefusion bekræfter årtiers forudsigelserDette øjebliksbillede af de første millisekunder i den voldsomme sammensmeltning af to neutronstjerner, beregnet og gengivet af associeret forsker David Radice og samarbejdspartnere, afslører stjerner
Neutronstjernefusion bekræfter årtiers forudsigelserDette øjebliksbillede af de første millisekunder i den voldsomme sammensmeltning af to neutronstjerner, beregnet og gengivet af associeret forsker David Radice og samarbejdspartnere, afslører stjerner -
 Uret tikker, mens SpaceX bygger fartøjer til NASAKredit:CC0 Public Domain To uger siden, NASA-chefen virkede træt af at vente på, at SpaceX og Boeing Co. skulle færdigudvikle de kapsler, der skal transportere amerikanske astronauter til og fra d
Uret tikker, mens SpaceX bygger fartøjer til NASAKredit:CC0 Public Domain To uger siden, NASA-chefen virkede træt af at vente på, at SpaceX og Boeing Co. skulle færdigudvikle de kapsler, der skal transportere amerikanske astronauter til og fra d -
 Striber i nordlys fundet til at kortlægge træk i jordens strålingsmiljøIllustrationen viser observationerne af hvidt lys af den fine struktur i nordlyset, der er overlejret over Alaska. Prikkerne, der angiver elektroner, er farvekodede for at vise deres oprindelse, med r
Striber i nordlys fundet til at kortlægge træk i jordens strålingsmiljøIllustrationen viser observationerne af hvidt lys af den fine struktur i nordlyset, der er overlejret over Alaska. Prikkerne, der angiver elektroner, er farvekodede for at vise deres oprindelse, med r -
 Masten er hævet til NASAs Mars 2020 roverMedlemmer af NASAs Mars 2020-projekt tager et øjeblik efter at have fastgjort fjernmålingsmasten til Mars 2020-roveren. Billedet er taget den 5. juni, 2019, i Spacecraft Assembly Facilitys High Bay 1
Masten er hævet til NASAs Mars 2020 roverMedlemmer af NASAs Mars 2020-projekt tager et øjeblik efter at have fastgjort fjernmålingsmasten til Mars 2020-roveren. Billedet er taget den 5. juni, 2019, i Spacecraft Assembly Facilitys High Bay 1
- Hvad er de bedste spørgsmål om Big Bang -teorien?
- Hvad er livets grundlæggende enheder?
- Hvad er egenskaberne ved gaspartikler?
- Hvor meget forstørrelse er der behov for for at se et nanometer?
- Ny tilgang nødvendig for at redde Australiens ikke-perenniale floder
- Evakuering under alvorlige naturbrandsscenarier


