Discovery hjælper med at forbedre nøjagtigheden af CRISPR-Cas9-genredigering
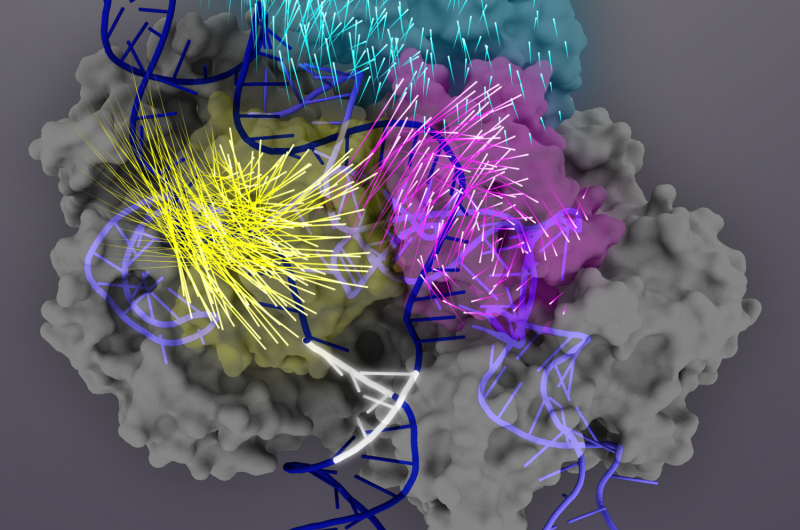
Cas9-proteinet (grå) er en RNA-styret nuklease, der kan programmeres til at binde og skære enhver matchende DNA-sekvens (mørkeblå dobbelthelix), hvilket gør det til et stærkt værktøj til genomteknologi. Ved målbinding, Cas9-proteindomæner gennemgår konformationelle omlejringer (bevægelserne af individuelle aminosyrer er repræsenteret af rakethaler) for at aktivere Cas9-sgRNA-komplekset til målspaltning. REC3-domænet (teal) er ansvarlig for målregistrering, som signalerer udadrotation af REC2-domænet (magenta) for at åbne en sti for HNH-nukleasedomænet (gul). Denne aktive konformation af Cas9 er derefter i stand til at udløse samordnet spaltning af begge strenge af mål-DNA'et. Kredit:Janet Iwasa grafik for Doudna Lab
Forskere ved University of California, Berkeley og Massachusetts General Hospital har identificeret en nøgleregion i Cas9-proteinet, der styrer, hvor præcist CRISPR-Cas9 huser på en mål-DNA-sekvens, og har justeret det til at producere en hyperpræcis geneditor med det laveste niveau af skæring uden for mål til dato.
Proteindomænet, som forskerne identificerede som en master-controller inden for DNA-skæring, er et oplagt mål for re-engineering for at forbedre nøjagtigheden yderligere, siger forskerne. Denne tilgang skulle hjælpe videnskabsmænd med at tilpasse varianter af Cas9 - proteinet, der binder og skærer DNA - for at minimere chancen for, at CRISPR-Cas9 vil redigere DNA på det forkerte sted, en vigtig overvejelse, når man laver genterapi hos mennesker.
En strategi for at opnå forbedret nøjagtighed er at skabe mutationer i det styrende proteindomæne, kaldet REC3, og se, hvilke der forbedrer nøjagtigheden uden at påvirke effektiviteten af skæring på mål.
"Vi har fundet ud af, at selv mindre ændringer i REC3-domænet af Cas9 påvirker forskellen mellem on- og off-target redigering, hvilket tyder på, at dette domæne er en oplagt kandidat til dybdegående mutagenese for at forbedre målretningsspecificiteten. I forlængelse af dette arbejde, man kunne udføre en mere upartisk mutagenese i REC3 end de målrettede mutationer, vi har lavet, " sagde co-first forfatter Janice Chen, en kandidatstuderende i Jennifer Doudnas laboratorium, som var med til at opfinde CRISPR-Cas9-genredigeringsværktøjet.
Co-first forfattere Chen, Yavuz Dagdas og Benjamin Kleinstiver, og deres kolleger ved UC Berkeley, Massachusetts General Hospital og Harvard University rapporterer deres resultater online i dag forud for offentliggørelse i tidsskriftet Natur .
Hyperpræcis Cas9
Siden 2012 har når Doudna, en professor i molekylær- og cellebiologi og en Howard Hughes Medical Institute-forsker ved UC Berkeley, og kollega Emmanuelle Charpentier ved Max Planck Institute for Infection Biology genbrugte Cas9-proteinet for at skabe en billig, præcis og nem at bruge gen-editor, forskere har forsøgt at mindske chancerne for redigering uden for målet. Mens forbedret troskab gavner grundforskning, det er helt afgørende, når man redigerer gener til kliniske applikationer, da enhver DNA-skæring uden for målet kan deaktivere nøglegener og føre til permanente, uventede bivirkninger.
Inden for de sidste to år, to teams konstruerede meget nøjagtige Cas9-proteiner - en forbedret specificitet kaldet eSpCas9(1.1) og en high-fidelity kaldet SpCas9-HF1 - og Chen og Doudna søgte at lære, hvorfor de skærer med højere specificitet end vildtype-Cas9-proteinet fra Streptococcus pyogenes, der bruges meget i dag.
I øjeblikket, forskere, der bruger CRISPR-Cas9, skaber et enkelt-guide RNA (sgRNA) - et RNA-molekyle, der inkluderer en kæde på 20 ribonukleinsyrer, der komplementerer en specifik 20-nukleinsyre DNA-sekvens, de ønsker at målrette mod - og knytter den til Cas9. Dette guide-RNA gør det muligt for Cas9 at komme ind på det komplementære DNA, bind til det og skær den dobbeltstrengede helix. Men Cas9-sgRNA-komplekset kan også binde til DNA, der ikke nøjagtigt matcher, fører til uønsket skæring uden for målet.
I 2015 Doudnas laboratorium opdagede en konformationel switch af Cas9, der aktiveres, når RNA-guiden og DNA-målet matcher. De fandt ud af, at kun når RNA'et og DNA'et matcher tæt, vil 3D-strukturen af Cas9, især konformationen af HNH-nukleasedomænet, ændre og aktiver saksen på Cas9. Imidlertid, processen, der er ansvarlig for sansning af nukleinsyrerne opstrøms for den konformationelle switch, forblev ukendt.
I den aktuelle undersøgelse, Chen og Dagdas brugte en teknik kaldet single-molecule FRET (Förster resonance energy transfer) til præcist at måle, hvordan de forskellige proteindomæner i Cas9-sgRNA proteinkomplekset - især REC3, REC2 og HNH - bevæger sig, når komplekset binder til DNA.
De fastslog først, at specificitetsfordelene tildelt af eSpCas9(1.1) og SpCas9-HF1 kunne forklares ved, at tærsklen for HNH-konformationsskiftet var meget højere for disse Cas9-varianter end for vildtype-Cas9-proteinet, hvilket gør eSpCas9(1.1)- og SpCas9-HF1-varianterne mindre tilbøjelige til at aktivere saksen, når de er bundet til en sekvens uden for målet.
Næste, de afslørede, at REC3-domænet er ansvarligt for at registrere nøjagtigheden af målbinding, som derefter signalerer den udadgående rotation af REC2-domænet for at åbne en sti for HNH-nukleasedomænet, aktivering af saksen. Denne aktive konformation af Cas9 er derefter i stand til at spalte begge strenge af mål-DNA'et.
Chen, Dagdas og Kleinstiver viste derefter, at ved at mutere dele af REC3, det er muligt at ændre specificiteten af Cas9-proteinet, så HNH-nukleasen ikke aktiveres, medmindre guide-RNA- og mål-DNA-matchen er meget tæt. De var i stand til at konstruere en forbedret hyperpræcis Cas9, døbt HypaCas9, der bevarer sin on-target-effektivitet, men er lidt bedre til at skelne mellem on- og off-target-steder i menneskelige celler.
"Hvis du muterer visse aminosyrerester i REC3, du kan justere balancen mellem Cas9 on-target aktivitet og forbedret specificitet; vi var i stand til at finde det søde sted, hvor der er tilstrækkelig aktivitet ved det tilsigtede mål, men også en stor reduktion af begivenheder uden for mål, " sagde Chen.
Ved at fortsætte med at udforske forholdet mellem struktur, funktion og dynamik af Cas9, Doudna og hendes team håber på at udvikle proteinet yderligere med udsøgt følsomhed til pålideligt og effektivt at udføre en række genetiske ændringer.
 Varme artikler
Varme artikler
-
 For bonoboer, det betaler sig at have magtfulde allieredeFizi, en voksen mandlig bonobo ved Lola ya Bonobo Sanctuary i Den Demokratiske Republik Congo. En ny undersøgelse af disse afrikanske aber antyder, hvordan menneskeligt samarbejde opstod. Kredit:Chris
For bonoboer, det betaler sig at have magtfulde allieredeFizi, en voksen mandlig bonobo ved Lola ya Bonobo Sanctuary i Den Demokratiske Republik Congo. En ny undersøgelse af disse afrikanske aber antyder, hvordan menneskeligt samarbejde opstod. Kredit:Chris -
 Typer af nerver i menneskekroppenVores hjerner er større end noget andet dyr, i forhold til vores kropsmasse, men de er stadig lavet af de samme typer nerver. Det samme gælder for vores perifere nervesystem, som består af de samme ty
Typer af nerver i menneskekroppenVores hjerner er større end noget andet dyr, i forhold til vores kropsmasse, men de er stadig lavet af de samme typer nerver. Det samme gælder for vores perifere nervesystem, som består af de samme ty -
 Hvad er celleafdeling, og hvorfor forekommer det?Celler er livets byggesten. Små, som de måtte være, har de flere opgaver at udføre og indeholder flere rum for mere effektivt at udføre de funktioner, de skal gøre for at holde dig i live. En grund
Hvad er celleafdeling, og hvorfor forekommer det?Celler er livets byggesten. Små, som de måtte være, har de flere opgaver at udføre og indeholder flere rum for mere effektivt at udføre de funktioner, de skal gøre for at holde dig i live. En grund -
 Selv vilde pattedyr har regionale dialekterKredit:Cardiff University Forskere fra Cardiff Universitys Otter Project har opdaget, at genetisk adskilte populationer af vilde oddere fra hele Storbritannien har deres egne regionale lugte til a
Selv vilde pattedyr har regionale dialekterKredit:Cardiff University Forskere fra Cardiff Universitys Otter Project har opdaget, at genetisk adskilte populationer af vilde oddere fra hele Storbritannien har deres egne regionale lugte til a
- Typer Pyrometre
- Forskere udforsker racemaser og foreslår strategier til at finde lægemidler, der er målrettet mod…
- GPM-satellitsonder gennembløder storme i det sydlige Texas og Golfen
- 10 hurtigste ting i universet
- Modernisering af first responder-træning med VR og talegenkendelse
- Hvad sker der med lufttryk med en stigning i vanddamp?


