Klumper som midlertidig opbevaring
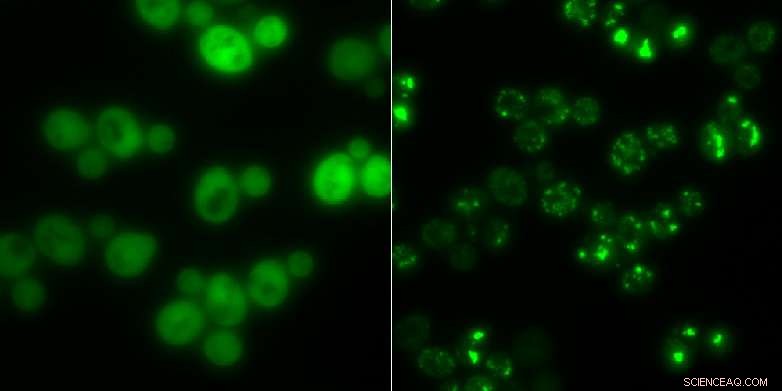
Gærceller uden proteinaggregater (til venstre) og dem med (lyse lysende pletter):I tider med sult, Klumperne tjener som midlertidig opbevaring for proteiner. Kredit:Matthias Peter / ETH Zürich
Forskere ved ETH har opdaget, at dannelsen af proteinaggregater i gærceller er reversibel. Dette kaster nyt lys over menneskelige sygdomme, der kan tilskrives visse proteinaggregater.
Proteinaggregater har et dårligt ry. En række menneskelige sygdomme, især nervesystemet, som Alzheimers, Parkinsons, eller amyotrofisk lateral sklerose (ALS), skyldes sammenklumpning af degenererede proteiner i nerveceller, skabe aggregater, som cellerne ikke kan opløse. Dette får cellerne til at dø.
Nu, forskere ledet af ETH -professor Matthias Peter og Reinhard Dechant har kastet nyt lys over proteinaggregater i en undersøgelse, der involverede gærceller. Den tilsvarende artikel er netop blevet offentliggjort i tidsskriftet Naturens cellebiologi . I det, ETH -forskerne viser, at proteinklumper dannes i gærceller som reaktion på stressfaktorer som næringsstofsult eller varme. Hvis cellerne overlever stressen, de kan opløse aggregaterne igen, hurtigt genbruge de enkelte komponenter, og bruge dem til cellulært stofskifte.
Klumper dannes som reaktion på stress
Forskernes opdagelse af enzymet Cdc19 er et eksempel på et protein, der klumper sig sammen under stress. Enzymet leverer energi til cellerne. Forskerne opdagede, at Cdc19 nedbrydes i fire identiske underenheder ved glukosesult. Disse underenheder ændrer derefter deres oprindelige form og klumper sig sammen med andre molekyler, såsom ribonukleinsyrer eller andre enzymer, at danne aggregater. Forskerne omtaler disse klumper som stressgranulat. Når først de er inkorporeret i et aggregat af denne art, Cdc19 bliver inaktiv og er ikke længere i stand til at producere brændstof til cellen. I løbet af denne tid, cellen kan hverken vokse eller formere sig.
Imidlertid, processen er reversibel. Så snart stressen er overstået, spændingskornene opløses, og de fire underenheder af Cdc19 samles, så enzymet kan genoptage sin rolle i glukosemetabolismen.
Klumperne har et klart formål, siger Matthias Peter:"Gærcellen bruger aggregater som en slags lager for vigtige enzymer, så disse er beskyttet mod nedbrydning i stresssituationer og kan reaktiveres umiddelbart efter, at cellen har overlevet stressen." han siger, beskytte disse molekyler mod at blive nedbrudt af cellens egne bortskaffelsesmekanismer. Hvis cellen skulle syntetisere disse forbindelser igen efter hver stresssituation, det ville koste cellen meget tid og energi.
En simpel sekvens er tilstrækkelig til klumpning
Forskerne afklarede også, hvordan og hvorfor Cdc19 er i stand til at danne klumper. I strukturen af en Cdc19-underenhed, de identificerede en kort, udfoldet underafsnit med en simpel sammensætning. I tekniske termer, disse sektioner er kendt som "low complexity regions" (LCR'er), og forskerne siger, at de også forekommer i andre aggregatdannende proteiner i andre organismer, inklusive mennesker.
"LCR'erne udsættes på grund af nedbrydningen af enzymkomplekset og udløser aggregeringsprocessen, ", siger Peter. "Det var derfor vigtigt for os at finde en sekvens af denne art i Cdc19. Dette bekræfter, at der er en generel mekanisme." I gærens normale tilstand, LCR for Cdc19 er skjult, eller har flere fosfatgrupper, som LCR'en "deaktiverer". Det er kun ved næringsstress, at LCR'en kommer frem og fosfatgrupperne fjernes – og først derefter kan der dannes aggregater.
Et vigtigt fund
"Vores forskning har skabt en følelse af en ny opvågning i det videnskabelige samfund, " siger Reinhard Dechant, gruppeleder ved Institut for Biokemi, der ledede undersøgelsen sammen med Matthias Peter. Indtil nu, han siger, aggregater blev primært set som patogene partikler, fordi det eneste synlige hos patienter er resultatet af processen – dvs. uopløselige proteinplakker, der forårsager en sygdom. "Vores papir undersøger også starten på aggregering, og hvordan den skrider frem, " siger Dechant, forklarer, at proteinklumper ikke vil dannes blot på grund af en sygdom, men snarere fordi cellen har brug for dem for at kunne overleve en stresssituation. "For første gang, vi var i stand til at vise, at både dannelse og nedbrydning af aggregater er en vigtig mekanisme i celler. "
Andre ETH Zürich-forskningsgrupper, der undersøger aggregater i gærceller, har tidligere gjort lignende opdagelser. Derfor, andre ETH-forskere var i stand til at påvise, at klumper af degenererede proteiner virker, blandt andet, kan lide en hukommelse og hjælpe cellerne med at gemme tidligere (negative) oplevelser (som rapporteret i ETH News). Det ser derfor ud til, at den funktionelle aggregering af visse proteiner er en udbredt reguleringsmekanisme.
Sidste artikelGlobalt forskerhold udfylder sproggabet i plantevidenskab
Næste artikelSundhedsforskere visualiserer et liv i silico
 Varme artikler
Varme artikler
-
 Beskyttede farvande fremmer genopblussen af stenfisk fra vestkystenVoksen bocaccio af fotograferet ud for det sydlige Californien med fjernbetjent køretøj. Kredit:Advanced Survey Technologies, Division for fiskeriressourcer, NOAA Fisheries/Southwest Fisheries Science
Beskyttede farvande fremmer genopblussen af stenfisk fra vestkystenVoksen bocaccio af fotograferet ud for det sydlige Californien med fjernbetjent køretøj. Kredit:Advanced Survey Technologies, Division for fiskeriressourcer, NOAA Fisheries/Southwest Fisheries Science -
 Cambodja beslaglægger en forsendelse af elfenben skjult i hule træstammerCambodjanske myndigheder fremviser stykker af indsmuglet elfenben Cambodja har beslaglagt næsten et ton elfenben skjult i udhulede træstammer og fundet inde i en forladt skibscontainer, sagde en e
Cambodja beslaglægger en forsendelse af elfenben skjult i hule træstammerCambodjanske myndigheder fremviser stykker af indsmuglet elfenben Cambodja har beslaglagt næsten et ton elfenben skjult i udhulede træstammer og fundet inde i en forladt skibscontainer, sagde en e -
 Det højeste partielle ilttryk i kredsløbssystemetPartielt tryk er en måling af mængden af kraft, der udøves af et bestemt stof i en blanding. Blod indeholder en blanding af gasser, som hver udøver tryk på siderne af blodkarene. De vigtigste gasser
Det højeste partielle ilttryk i kredsløbssystemetPartielt tryk er en måling af mængden af kraft, der udøves af et bestemt stof i en blanding. Blod indeholder en blanding af gasser, som hver udøver tryk på siderne af blodkarene. De vigtigste gasser -
 Hvordan udviklede skrivningen sig?Mesopotamien © 2010 HowStuffWorks.com Antropologer og arkæologer elsker at mødes for at tale om de forskellige karakteristika, der udgør et civiliseret samfund. Mens de finere punkter diskuteres, der
Hvordan udviklede skrivningen sig?Mesopotamien © 2010 HowStuffWorks.com Antropologer og arkæologer elsker at mødes for at tale om de forskellige karakteristika, der udgør et civiliseret samfund. Mens de finere punkter diskuteres, der
- Forskere skal udvikle mere realistiske modeller for lægemiddel- og nanopartikeloptagelse
- Kraftfuld forudsigelse:Find en bedre måde at forudsige orkanstyrke på
- Små arktiske kystvandområder, med stor kulstoffrigivelse
- Om mindre og store landformer
- Grøn tilgang fremskynder procesoptimering og hentning af omskiftelige opløsningsmidler
- Er kvantecomputere en trussel mod cybersikkerhed?


