Forskere udvikler CRISPR til at redigere enkelte RNA-bogstaver i menneskelige celler
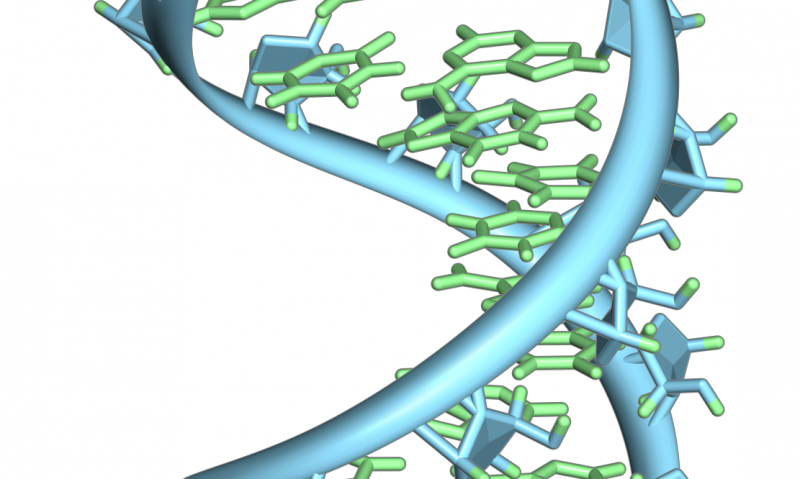
En hårnålesløjfe fra et præ-mRNA. Fremhævet er nukleobaserne (grønne) og ribose-phosphat-rygraden (blå). Bemærk, at dette er en enkelt streng af RNA, der foldes tilbage på sig selv. Kredit:Vossman/ Wikipedia
Forskere fra Broad Institute og MIT, der først udnyttede CRISPR til redigering af pattedyrs genom, har konstrueret et nyt molekylært system til effektiv redigering af RNA i humane celler. RNA redigering, som kan ændre genprodukter uden at foretage ændringer i genomet, har et dybt potentiale som værktøj til både forskning og sygdomsbehandling.
I et papir offentliggjort i dag i Videnskab , seniorforfatter Feng Zhang og hans team beskriver det nye CRISPR-baserede system, kaldet RNA-redigering til programmerbar A til I-erstatning, eller "REPARATION". Systemet kan ændre enkelte RNA-nukleosider i pattedyrsceller på en programmerbar og præcis måde. REPAIR har evnen til at vende sygdomsfremkaldende mutationer på RNA-niveau, såvel som andre potentielle terapeutiske og grundlæggende videnskabelige anvendelser.
"Evnen til at korrigere sygdomsfremkaldende mutationer er et af de primære mål for genomredigering, " sagde Zhang, et kerneinstitutmedlem ved Broad Institute og efterforsker ved McGovern Institute for Brain Research ved MIT. "Indtil nu, vi er blevet meget gode til at inaktivere gener, men faktisk er det meget mere udfordrende at genvinde tabt proteinfunktion. Denne nye evne til at redigere RNA åbner op for flere potentielle muligheder for at genoprette denne funktion og behandle mange sygdomme, i næsten enhver form for celle."
REPAIR har evnen til at målrette individuelle RNA-bogstaver, eller nukleosider, at skifte adenosiner til inosiner (læses som guanosiner af cellen). Disse bogstaver er involveret i enkeltbaseændringer, der er kendt for regelmæssigt at forårsage sygdom hos mennesker. Ved menneskelig sygdom, en mutation fra G til A er ekstremt almindelig; disse ændringer er blevet impliceret i, for eksempel, tilfælde af fokal epilepsi, Duchenne muskeldystrofi, og Parkinsons sygdom. REPAIR har evnen til at vende virkningen af enhver patogen G-til-A-mutation uanset dens omgivende nukleotidsekvens, med potentiale til at fungere i enhver celletype.
I modsætning til de permanente ændringer af genomet, der kræves til DNA-redigering, RNA-redigering giver en sikrere, mere fleksibel måde at foretage korrektioner i cellen. "REPAIR kan fikse mutationer uden at manipulere med genomet, og fordi RNA naturligt nedbrydes, det er en potentielt reversibel løsning, " forklarede co-first forfatter David Cox, en kandidatstuderende i Zhangs laboratorium.
For at oprette REPAIR, forskerne profilerede systematisk CRISPR-Cas13-enzymfamilien for potentielle "redaktør"-kandidater (i modsætning til Cas9, Cas13-proteinerne målretter og skærer RNA). De valgte et enzym fra Prevotella-bakterier, kaldet PspCas13b, som var den mest effektive til at inaktivere RNA. Holdet konstruerede en deaktiveret variant af PspCas13b, der stadig binder til specifikke strækninger af RNA, men mangler sin "sakse-lignende" aktivitet, og fusionerede det til et protein kaldet ADAR2, som ændrer nukleosidet adenosin til inosin i RNA-transkripter.
I REPARATION, det deaktiverede Cas13b-enzym opsøger en målsekvens af RNA, og ADAR2-elementet udfører nukleosidkonverteringen uden at skære transkriptet eller stole på nogen af cellens native maskineri.
Holdet ændrede yderligere redigeringssystemet for at forbedre dets specificitet, reduktion af detekterbare redigeringer uden for målet fra 18, 385 til kun 20 i hele transkriptomet. Den opgraderede inkarnation, REPARATION v2, opnåede konsekvent den ønskede redigering i 20 til 40 procent – og op til 51 procent – af et målrettet RNA uden tegn på væsentlig aktivitet uden for målet. "Den succes, vi havde med at udvikle dette system, er opmuntrende, og der er tydelige tegn på, at REPAIRv2 kan udvikles yderligere for mere robust aktivitet, mens specificiteten bevares, " sagde Omar Abudayyeh, co-first forfatter og en kandidatstuderende i Zhangs laboratorium.
For at demonstrere REPAIRs terapeutiske potentiale, holdet syntetiserede de patogene mutationer, der forårsager Fanconi-anæmi og X-bundet nefrogen diabetes insipidus, introducerede dem i menneskelige celler, og korrigerede disse mutationer med succes på RNA-niveau. For at skubbe de terapeutiske muligheder yderligere, holdet planlægger at forbedre REPAIRv2's effektivitet og pakke det ind i et leveringssystem, der er passende til at introducere REPAIRv2 i specifikke væv i dyremodeller.
Forskerne arbejder også på yderligere værktøjer til andre typer nukleosid-omdannelser. "Der er enorm naturlig mangfoldighed i disse enzymer, " sagde co-first forfatter Jonathan Gootenberg, en kandidatstuderende i både Zhangs laboratorium og laboratoriet hos Broad core institutmedlem Aviv Regev. "Vi søger altid at udnytte naturens kraft til at udføre disse ændringer."
Zhang, sammen med Broad Institute og MIT, planlægger at dele REPAIR-systemet bredt. Som med tidligere CRISPR-værktøjer, grupperne vil gøre denne teknologi frit tilgængelig for akademisk forskning via Zhang-laboratoriets side på plasmiddelingswebstedet Addgene, hvorigennem Zhang-laboratoriet allerede har delt reagenser mere end 42, 000 gange med forskere på mere end 2, 200 laboratorier i 61 lande, fremskynde forskning rundt om i verden.
 Varme artikler
Varme artikler
-
 Massiv Angel Oak har været vidne til 500 års historie i South CarolinaSouth Carolinas Angel Oak sidder i sin egen park, Angel Oak Park, på Johns Island og har endda sin egen adresse, 3688 Angel Oak Road. Mike Norton/Flickr Hvad er så englet ved et knudret egetræ, der p
Massiv Angel Oak har været vidne til 500 års historie i South CarolinaSouth Carolinas Angel Oak sidder i sin egen park, Angel Oak Park, på Johns Island og har endda sin egen adresse, 3688 Angel Oak Road. Mike Norton/Flickr Hvad er så englet ved et knudret egetræ, der p -
 Får regndage dig virkelig ned?Synes studierne er lidt blandede, videnskabelig forskning viser, at regn ikke påvirker humøret negativt hos de fleste mennesker. Stephanie Keith/Getty Images Hvis du nogensinde er blevet rørt af afdø
Får regndage dig virkelig ned?Synes studierne er lidt blandede, videnskabelig forskning viser, at regn ikke påvirker humøret negativt hos de fleste mennesker. Stephanie Keith/Getty Images Hvis du nogensinde er blevet rørt af afdø -
 Lilla plante er i defensivenLavendel har en naturlig evne til at tiltrække bier og afskrække andre insekter, der kan skade det. Kredit:UBC Okanagan Mens lavendel længe har været kendt for sin stærke duft og beroligende olier
Lilla plante er i defensivenLavendel har en naturlig evne til at tiltrække bier og afskrække andre insekter, der kan skade det. Kredit:UBC Okanagan Mens lavendel længe har været kendt for sin stærke duft og beroligende olier -
 Har prokaryoter cellevægge?Prokaryoter repræsenterer en af de to store klassifikationer i livet. De andre er eukaryoter . Prokaryoter er adskilt af deres lavere niveau af kompleksitet. De er alle mikroskopiske, skønt
Har prokaryoter cellevægge?Prokaryoter repræsenterer en af de to store klassifikationer i livet. De andre er eukaryoter . Prokaryoter er adskilt af deres lavere niveau af kompleksitet. De er alle mikroskopiske, skønt
- Succes for indiske madprogrammer afhænger af politisk aktivering af statens kapacitet
- En ubrydelig kombination af usynlig blæk og kunstig intelligens
- NASA indstiller arbejdet på måneraketten på grund af virus
- Borat bioaktivt glas i nanoskala:Et næste generations materiale til hudheling
- Hvad er formålet med faktoranalyse?
- Observation af skyrmion vejrtrækningsbevægelse med røntgenteknik


