Infektionssygdomme:CTRL + ALT + Slet

Sandia National Laboratories' Safe Genes-projektteammedlemmer, Kyle Seamon, venstre, Oscar Negrete, anden fra venstre, hovedefterforsker Joe Schoeniger, siddende, og Edwin Saada, arbejder på genredigering. Kredit:Dino Vournas
Genredigering revolutionerer det biovidenskabelige forskningslandskab og har store løfter om at "slette" sygdomme fra menneskekroppe. Sandia National Laboratories arbejder på at gøre denne teknologi mere sikker og for at sikre, at den en dag kan leveres til mennesker uden at udløse negative immunsystemreaktioner eller forårsage andre uønskede bivirkninger.
Sandia biokemiker Joe Schoeniger forklarer, at genredigeringsteknologi er baseret på et "milliard år gammelt våbenkapløb" mellem bakterier og vira, der forsøger at angribe dem.
Bakterier gemmer stumper af invaderende viralt DNA ved hjælp af et system kaldet Clustered Regularly Interspaced Short Palindromic Repeats eller CRISPR. Dette system hjælper bakterier med at genkende en virus, når den vender tilbage til et gentaget angreb. CRISPR-systemet producerer Cas9, et enzym, der binder sig til det krænkende virale DNA, så skærer og ødelægger det.
Dette bakterielle forsvarssystem kan programmeres. Forskere kan sende CRISPR-Cas9 til et præcist sted for at ændre en bestemt bit af DNA.
Evnen til at ændre DNA er nyttig, især når man beskæftiger sig med genetiske sygdomme, men ændringer i DNA er i øjeblikket irreversible. Brug af teknologien, som den er i dag, kan forårsage utilsigtede, farlige og permanente bivirkninger. Det kunne skære et genom på det forkerte sted (dvs. har virkninger uden for målet), potentielt forårsage sygdom.
Ud over, CRISPR-Cas9 har brug for en bærer, der skal afleveres i humane celler. Typisk, denne bærer er en virus forbundet med almindelig forkølelse kaldet adeno-associeret virus. Ifølge Sandia-virolog Oscar Negrete, et flertal af mennesker har været udsat for stammer af denne virus på et tidspunkt. Det betyder, at folk er hurtige til at fremstille antistoffer mod det, gør det til en engangsterapi. Selv ved den første brug, patienter har sandsynligvis en immunreaktion, Negrete forklarede. Nye tilgange er nødvendige, som gør det muligt at bruge behandlingen med succes mere end én gang, hvis det er nødvendigt.
Styring af CRISPR
For at kunne kontrollere CRISPR-teknologien og bruge den uden at forårsage permanente DNA-ændringer, Defense Advanced Research Projects Agency oprettede Safe Genes -programmet.
En indsats, der finansieres under Safe Genes, er $2,5 millioner, toårigt projekt ledet af Jennifer Doudnas laboratorium ved University of California, Berkeley, i samarbejde med Sandia, og University of California, San Francisco. Doudna er en pioner inden for udviklingen af CRISPR. Hvis den tidlige forskning er frugtbar, DARPA kunne forlænge denne indsats med yderligere to år, hvilket bringer det samlede beløb op på fire år og $5 mio.
Vira er dygtige til at ændre deres DNA og generere nye anti-CRISPR-proteiner for at blokere de bakterielle immunsystemer. Dette er den anden side af bakterie-virus-"våbenkapløbet". Disse proteiner kan fungere som modgift, gør det muligt at slå geneditorer fra, hvis det er nødvendigt.
Safe Genes-teamet udnytter disse proteiner til at udvikle hæmmere, der kan kontrollere off-target-effekter af CRISPR. Schoeniger sagde, at hvis en dosis af en geneditor skulle administreres, det kunne efterfølges af en dosis af inhibitoren for at slukke for det, minimere den tid, hvor virkninger uden for målet kan finde sted.
Genopretter lasten
Dette Safe Genes-projekt bygger på det igangværende arbejde hos Sandia, som også er fokuseret på at bekæmpe infektionssygdomme ved hjælp af genredigering.
Normalt, CRISPR-systemet retter sig mod DNA, men Sandia har samarbejdet med Doudnas team for at skabe et CRISPR-system, der er rettet mod RNA i stedet. At angribe virus-RNA direkte vil sandsynligvis være effektivt mod de fleste patogener af biosikkerhed, sagde Negrete.
CRISPR-systemer eksisterer allerede, der målretter RNA, men disse systemer resulterer i generel RNA-nedbrydning. Dette nye RNA-målretningssystem kan påvirke specifikt humant eller dyrt RNA, herunder dem, der vides at kode for proteiner, der hjælper med virusinfektion.
"Nogle proteiner er kendte gateways for angribere, Negrete forklarede. "Hvis du slår disse proteiner ud via deres kodende RNA'er, patogenerne kan ikke trænge ind i dine celler, og du har ikke foretaget nogen permanente ændringer i dit genom."
Udvikling af sikre CRISPR-applikationer
Til Safe Genes-projektet, Sandia vil teste RNA-målrettet CRISPR-teknologien mod en række forskellige vira. Sandia-teamet vil levere CRISPR'erne til pattedyrsceller inficeret med en række RNA-vira, inklusive Ebola og Rift Valley Fever Virus, der forårsager symptomer såsom hæmoragisk feber. Så vil de måle niveauet af virus, der er tilbage i cellerne efter behandlingen.
"Ideelt set vi vil gerne se niveauet af virus reduceret til nul. Hvis det ikke er, CRISPR -teknologien skulle ændres, " sagde Negrete.
Ud over, UCSF-teamet udvikler CRISPR-afledte teknologier til at tænde og slukke for gener uden at redigere DNA. For denne ansøgning, holdet udnytter CRISPR til målrettet DNA-methylering. DNA-methylering er en ikke-destruktiv mekanisme for genekspressionsregulering, der forekommer naturligt gennem hele pattedyrets livscyklus.
Negrete mener, at dette arbejde, hvis det lykkes, would represent a quantum leap forward for virology because the new CRISPR technologies would attack illnesses in multiple ways. I øjeblikket, vaccines target single strains of a virus. Sandia's Safe Genes project is working toward solutions that target all the strains of a virus, as well as finding ways to repair infected host and human cells.
"It's cumbersome to create new treatments for each and every bug, and not feasible for quickly responding to emerging threats. One treatment for each and every strain that appears, as well as all the related viruses – it's a much better strategy, " Negrete said. "It's like the leap from eliminating one letter with a pencil eraser to hitting control-A and deleting an entire paragraph."
 Varme artikler
Varme artikler
-
 Forskellen mellem det Somatic & Autonomic SystemNervesystemet er det, der giver levende ting mulighed for at få og behandle oplysninger fra det ydre miljø og konvertere disse oplysninger til instruktioner. Dine fem grundlæggende sanser - berøring,
Forskellen mellem det Somatic & Autonomic SystemNervesystemet er det, der giver levende ting mulighed for at få og behandle oplysninger fra det ydre miljø og konvertere disse oplysninger til instruktioner. Dine fem grundlæggende sanser - berøring, -
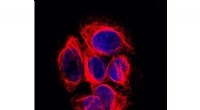 Uventet fund løser 40 år gammelt cytoskelet-mysteriumSeks melanomceller. Deres DNA (blåt) findes i cellekernen, deres mikrotubuli (røde) i cytoplasmaet, omkring kernen. Kredit:Netherlands Cancer Institute Forskere har ledt efter det i årtier:enzymet
Uventet fund løser 40 år gammelt cytoskelet-mysteriumSeks melanomceller. Deres DNA (blåt) findes i cellekernen, deres mikrotubuli (røde) i cytoplasmaet, omkring kernen. Kredit:Netherlands Cancer Institute Forskere har ledt efter det i årtier:enzymet -
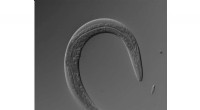 Kostbegrænsning og levetid hos mandlige og hermafrodite ormeMikroskopibillede af en hermafrodit C. elegans . Kredit:Nishida Lab En organismes levetid er kendt for at være påvirket af dets køn og kost, men hvor disse to faktorer overlapper biologisk ikke
Kostbegrænsning og levetid hos mandlige og hermafrodite ormeMikroskopibillede af en hermafrodit C. elegans . Kredit:Nishida Lab En organismes levetid er kendt for at være påvirket af dets køn og kost, men hvor disse to faktorer overlapper biologisk ikke -
 Stop og gå i kaliumkanalenFysikeren arbejder med meget grundlæggende kaliumkanaler for ikke at gøre analysen unødigt kompliceret. Kredit:Katrin Binner Celler har brug for åbninger i cellemembranen for at kunne foretage udv
Stop og gå i kaliumkanalenFysikeren arbejder med meget grundlæggende kaliumkanaler for ikke at gøre analysen unødigt kompliceret. Kredit:Katrin Binner Celler har brug for åbninger i cellemembranen for at kunne foretage udv
- Statisk friktion: Definition, koefficient & ligning (m /eksempler)
- Den globale vandcyklus er blevet mere intens:New Zealands våde områder vådere, og tørre tørrere
- Åndbar elektronik baner vejen for mere funktionel bærbar teknologi
- Omdannelse af kuldioxid til kulilte ved hjælp af vand, elektricitet
- Ti måder at lære dine børn gennem leg under COVID-19
- Sådan ændres blandede fraktioner til forkerte fraktioner


