Omdannelse af kuldioxid til kulilte ved hjælp af vand, elektricitet

Reduktion af CO 2 . Kredit:Mr. Aditya Prajapati
Forskere ved University of Illinois i Chicago og Joint Center for Artificial Photosynthesis har fastslået, hvordan elektrokatalysatorer kan omdanne kuldioxid til kulilte ved hjælp af vand og elektricitet. Opdagelsen kan føre til udvikling af effektive elektrokatalysatorer til produktion i stor skala af syntesegas - en blanding af kulilte og brint.
"Den elektrokemiske reduktion af kuldioxid til brændstoffer er et emne af stor interesse, fordi det tilbyder et middel til at lagre elektricitet fra energikilder som vind og solstråling i form af kemiske bindinger, "sagde Meenesh Singh, adjunkt i kemiteknik og hovedforfatter på undersøgelsen offentliggjort i tidsskriftet Procedurer fra National Academy of Sciences .
Under sin postdoktorale forskning ved University of California, Berkeley, Singh studerede kunstig fotosyntese og var en del af et team, der udviklede kunstige blade, der, når de udsættes for direkte sollys, var i stand til at omdanne kuldioxid til brændstoffer.
I sin seneste forskning, Singh udviklede en state-of-the-art multiscale model, der forener en kvantekemisk analyse af reaktionsvej; en mikrokinetisk model af reaktionsdynamikken; og en kontinuummodel for transport af arter i elektrolytten for at lære præcist, hvordan kuldioxid kan reduceres elektrokemisk gennem en katalysator, i dette tilfælde sølv, og lavet til kulilte.
Mens den mest sandsynlige reaktionsvej normalt identificeres ud fra kvantekemisk beregning af den laveste frienergibane, denne tilgang kan være vildledende, når dækninger af adsorberede arter adskiller sig væsentligt, Sagde Singh. Det er essentielt, derfor, at integrere virkningerne fra elektroniske tilstande af en katalysator på atomniveau med dynamikken i arter i elektrolytten på kontinuumniveau for nøjagtig forudsigelse af elektrokatalytiske reaktionsveje.
"Denne multiscale -model er en af de største præstationer inden for elektrokemi, " han sagde.
For at forstå, hvordan elektrokatalysatorer i brændselsceller eller elektrokemiske celler fungerer, forskere skal først undersøge de elektroniske og kvante niveauer, som kan være ekstremt udfordrende i nærvær af et elektrisk felt, sagde Jason Goodpaster, adjunkt i kemi ved University of Minnesota og en af medforfatterne. Det tog Singh og Goodpaster mere end et år at individuelt producere og benchmark modellerne og integrere dem i en multiscale ramme for fuldskala simulering af den elektrokemiske reaktion.
Det er første gang, Singh sagde, at forskere kvantitativt har forudsagt ud fra de første principper, den aktuelle tæthed af kulilte og hydrogen som en funktion af anvendt potentiale og tryk af kuldioxid.
"Når du først genkender, hvordan disse reaktioner sker på elektrokatalysatorer, du kan kontrollere katalysatorernes struktur og driftsbetingelser for effektivt at producere kulilte, "Singh sagde. Da de er produktgasser - kulilte og hydrogen er uopløselige i vandige elektrolytter - kan de let adskilles som syntesegas og omdannes til brændstoffer, såsom methanol, dimethylether, eller en blanding af carbonhydrider.
Elektrokatalysatorer som guld, sølv, zink, palladium og gallium vides at give blandinger af kuldioxid og hydrogen i forskellige forhold afhængigt af den påførte spænding, Sagde Singh. Guld og sølv udviser den højeste aktivitet mod reduktion af kuldioxid, og da sølv er mere rigeligt og billigere end guld, "sølv er den mere lovende elektrokatalysator til storskalaproduktion af kulilte, " han sagde.
 Varme artikler
Varme artikler
-
 Bekæmpelse af antibiotikaresistens med fagerKredit:CC0 Public Domain Landmænd over hele verden er afhængige af antibiotika for at holde husdyr sunde, men øget bakteriel resistens har skabt problemer for både dyr og mennesker. I stedet for d
Bekæmpelse af antibiotikaresistens med fagerKredit:CC0 Public Domain Landmænd over hele verden er afhængige af antibiotika for at holde husdyr sunde, men øget bakteriel resistens har skabt problemer for både dyr og mennesker. I stedet for d -
 Titrering af natriumcarbonat med saltsyreDu kan bruge titreringsteknikken til at bestemme koncentrationen af en natriumcarbonatopløsning ved hjælp af en opløsning med en kendt koncentration af saltsyre, eller omvendt. HCI reducerer gradvis
Titrering af natriumcarbonat med saltsyreDu kan bruge titreringsteknikken til at bestemme koncentrationen af en natriumcarbonatopløsning ved hjælp af en opløsning med en kendt koncentration af saltsyre, eller omvendt. HCI reducerer gradvis -
 Forskere udvikler wolfram-baserede brintdetektorerMorfologien af Pt/WOx/SiC-strukturen. Kredit:V.V. Zuyev et al./et brev til Journal of Technical Physics, 2015 Et hold fysikere fra Immanuel Kant Baltic Federal University har sammen med deres ko
Forskere udvikler wolfram-baserede brintdetektorerMorfologien af Pt/WOx/SiC-strukturen. Kredit:V.V. Zuyev et al./et brev til Journal of Technical Physics, 2015 Et hold fysikere fra Immanuel Kant Baltic Federal University har sammen med deres ko -
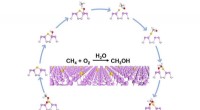 Guld-fosfor nanoplader katalyserer naturgas til grønnere energi selektivtSkematisk diagram af reaktionsvejen for methanoxidation over Au1/BP nanoark. Kredit:LUO Laihao Fremskridt inden for hydraulisk fraktureringsteknologi har gjort det muligt at opdage store reserver
Guld-fosfor nanoplader katalyserer naturgas til grønnere energi selektivtSkematisk diagram af reaktionsvejen for methanoxidation over Au1/BP nanoark. Kredit:LUO Laihao Fremskridt inden for hydraulisk fraktureringsteknologi har gjort det muligt at opdage store reserver
- Undersøgelse undersøger insekticiders virkninger på honningbier
- Ny undersøgelse af planktonskaller vælter årtier gammel forståelse af deres dannelse og kemi
- Jupiter havde vækstforstyrrelser
- Sådan beregnes reaktionsmassen i en blanding
- Hvordan døde Franklin -ekspeditionsbesætningen?
- Metalartefakter i Sydøstasien udfordrer langvarig arkæologisk teori


