Hvordan et ikonisk fotografi af et æble inspirerede til en forbedret cellulær analyse
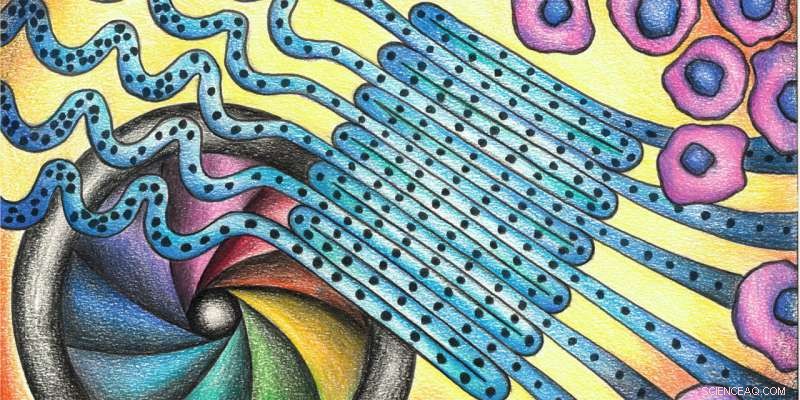
En gennemprøvet metode forenklet:mange celler strømmer gennem parallelle sløjfer, giver dem mulighed for at blive målt sammen i stedet for efter hinanden. Kredit:deMello Group/Chem
Det er vanskeligt at identificere et lille antal patogene celler blandt mange millioner celler. Forskere ved ETH Zürich har nu udviklet en teknologi, der er i stand til at identificere enorme mængder af celleegenskaber i lille skala, individuelt og detaljeret.
Alle livsprocesser hos mennesker, dyr og planter er afhængige af cellulær aktivitet. Den menneskelige krop alene indeholder mere end 210 celletyper med specifikke egenskaber og funktioner, der påvirker udvikling og sundhed. En detaljeret forståelse af disse celler og deres egenskaber er afgørende for biologi og medicin. Imidlertid, filtrering af den efterspurgte celleinformation er nogle gange en enorm udfordring – især hvis, ud af en million celler, færre end et dusin har den egenskab, der udløser en sygdom.
En etableret metode i kemi, biologi og medicin til hurtigt at bestemme egenskaberne af et stort antal individuelle celler er flowcytometri. Denne cellemålingsteknologi kan bruges, for eksempel, at identificere kræftceller eller T-celler, de hvide blodlegemer, der er vigtige for immunforsvaret.
Teknologien blev opfundet i 1968, med konventionelle flowcytometre, der normalt måler spredt lys og fluorescens, når celler strømmer gennem en laserstråle. De resulterende signaler varierer afhængigt af størrelsen, form, struktur og farve af cellerne; for eksempel, T-celler er meget glatte og spreder mindre lys end andre celler.
En god kombination
Forskergruppen ledet af Andrew deMello, ETH professor i biokemisk teknik, er det nu lykkedes at udvikle flowcytometri væsentligt yderligere. Dens billeddannelsesbaserede cytometriplatform måler celler og deres egenskaber hurtigere, i større mængder og langt mere præcist end nutidens flowcytometre. ETH Zürich-forskerne har nu præsenteret deres metodes virkemåde i det videnskabelige tidsskrift Chem .
Forskerne har ikke genopfundet tilgangen, men temmelig smart kombinerede eksisterende teknologier:deres flowcytometer kombinerer mikrofluidikkens muligheder, som studerer væskes adfærd gennem mikrokanaler, med meget følsomme optiske detektionsmetoder og ultrahurtig billeddannelse.
Dette giver dem mulighed for at opnå en ultrahøj gennemstrømning på mere end 50, 000 celler i sekundet. Standard fluorescerende-baserede flowcytometre måler pålideligt mellem 100 og 20, 000 celler i sekundet, og billeddannende flowcytometre kun op til 4, 000 celler i sekundet. I praksis, imidlertid, det er normalt sådan, at der måles væsentligt færre celler, da de normalt klumper sig sammen.
"Vi udvikler teknologier til at hjælpe kemikere, biologer og medicinske specialister udfører ny forskning, " siger deMello. Han forventer, at platformen en dag også bliver enklere og meget billigere end nutidens instrumenter.
I princippet, deres flowcytometer består af tre dele:ved starten, cellerne er opstillet tæt i en enkelt fil. En mikrofluidisk strøm leder dem derefter gennem en serpentin-mikrokanal (se tegningen ovenfor) og ind i detektionsområdet med høj hastighed. der, et kamera med høj opløsning registrerer deres størrelse, form og struktur ved hjælp af lyseffekterne. I et sidste trin, de kan sorteres efter deres egenskaber.
Snapshots på loops
Et særligt træk ved denne tilgang er, at cellerne passerer gennem flere parallelle sløjfer, som gør det muligt for kameraet at optage et stort antal celler med præcision. Dette fremskynder deMellos metode, og tillader drift ved exceptionelt høje gennemløb. "Kombinationen af mikrovæsker med billedbehandling muliggør forbedring af information, " siger han. I konventionelle tilgange, i modsætning, en detektor registrerer den ene celle efter den anden på et bestemt punkt.

En klassiker:"Bullet through Apple" (1964), Harold Edgerton. Kredit:© 2010 MIT. Udlånt af MIT Museum
Tre typer billeder kan opnås med denne teknologi:mørkefeltsbilleder med information om formen og strukturen af en celle (disse billeder viser farvede strukturer mod en mørk baggrund), lysfeltbilleder med information om cellestørrelsen og fluorescerende billeder med information om en celles udseende og indre struktur. Især udvindingen af morfologisk information adskiller deMellos tilgang fra andre fluorescerende eller mikrofluidbaserede tilgange.
Billedbehandling som Papa Flash
Da de stødte på et problem, deMellos gruppe nød godt af mange års erfaring med dråbebaseret mikrofluidik og optiske metoder:når dråber, celler eller mikropartikler flyder meget hurtigt, billederne – som med fotografier – bliver nogle gange forvrængede eller slørede. Forskergruppen løste dette problem ved at lære af fortiden:at blotlægge cellerne, de brugte stroboskopisk belysning, der nedbryder den kontinuerlige strøm af celler – som et slowmotion-kamera – til en sekvens af stillbilleder. Denne metode blev verdensberømt takket være opfinderen af stroboskopflashen, Harold E. Edgerton, også kendt som Papa Flash, hvis kultbilleder fra 1960'erne blev set rundt om i verden.
Takket være stroboskopisk eksponering, individuelle celler, der bevæger sig med en halv meter i sekundet og i store mængder, kan tydeligt registreres.
For at teste effektiviteten af deres metode, deMello's senior videnskabsmand, Stavros Stavrakis, sammen med to kandidatstuderende analyseret en stor cellepopulation og differentieret levende, døende og døde celler på baggrund af deres fluorescens. ETH Zürich-forskerne vil gerne videreudvikle metoden med henblik på bakteriel, nanovidenskabelige og industrielle anvendelser.
Sidste artikelBakterier som pacemaker til tarmen
Næste artikelAntibiotikaresistens:Forskere lykkes med at blokere resistensgener
 Varme artikler
Varme artikler
-
 Hvordan udviklede sproget sig?Denne hulemand klarer sig med lidt hjælp fra sine venner. Paul Harris/Getty Images Dyr kan muligvis ikke danne ord, men de kan bestemt kommunikere. Fugle bruger sange og opkald, og andre dyr bruger e
Hvordan udviklede sproget sig?Denne hulemand klarer sig med lidt hjælp fra sine venner. Paul Harris/Getty Images Dyr kan muligvis ikke danne ord, men de kan bestemt kommunikere. Fugle bruger sange og opkald, og andre dyr bruger e -
 Typer af sporedannende bakterierSporedannende bakterier er sværere end den gennemsnitlige mikroskopiske encellede organisme. Disse arter, der inkluderer slægterne Bacillus , Clostridium og Sporolactobacillus , kan omgiver sig me
Typer af sporedannende bakterierSporedannende bakterier er sværere end den gennemsnitlige mikroskopiske encellede organisme. Disse arter, der inkluderer slægterne Bacillus , Clostridium og Sporolactobacillus , kan omgiver sig me -
 Hvad er Missyplicity -projektet?Missy var så elsket i livet, hun blev genstand for en posthum kloningsindsats. Se flere kloningsbilleder. BioArts International Nogle mennesker tror, at deres hunde er helt værd at konstant fodre,
Hvad er Missyplicity -projektet?Missy var så elsket i livet, hun blev genstand for en posthum kloningsindsats. Se flere kloningsbilleder. BioArts International Nogle mennesker tror, at deres hunde er helt værd at konstant fodre, -
 Monster opdaget i canadisk ArktisMonstrillopsis planifrons, eller fladhovedet monster. Kredit:Aurelie Delaforge En kandidatstuderende fra University of Manitoba opdagede Canadas første, ægte, videnskabeligt forsvarligt monster, d
Monster opdaget i canadisk ArktisMonstrillopsis planifrons, eller fladhovedet monster. Kredit:Aurelie Delaforge En kandidatstuderende fra University of Manitoba opdagede Canadas første, ægte, videnskabeligt forsvarligt monster, d
- 1897 Lake Elmo UFO Encounter
- Første forsøg af sin art for at udforske planktons indvirkning på jordens kulstofkredsløb
- Hold det enkelt - Syntetisering af nyttige organiske forbindelser er nu blevet lettere og billigere
- Topologiske defekter producerer eksotisk mekanik i komplekse metamaterialer
- Emission fra blazaren 1ES 1218+304 udforsket med NASA-rumteleskoper
- En stabil bolig i spædbarnsalderen giver livslange fordele


