Bioingeniører opdager mekanismer, der regulerer cellers kraftværker
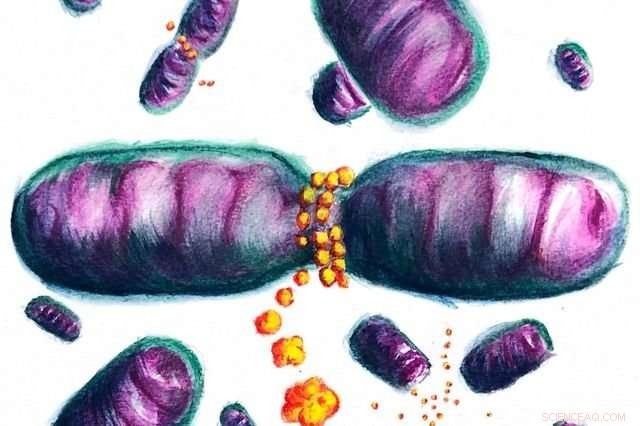
I denne kunstners gengivelse, Dnm1-proteiner, der omgiver en mitokondrie, deler den op i to. Kredit:Jaime de Anda/ACS Central Science
UCLA bioingeniører og deres kolleger har opdaget et nyt perspektiv på, hvordan celler regulerer størrelsen af mitokondrier, de dele af celler, der leverer energi, ved at skære dem i mindre enheder.
Forskerne skrev, at dette fund, demonstreret med gærproteiner, kunne i sidste ende bruges til at hjælpe med at behandle menneskelige sygdomme forbundet med en ubalanceret regulering af mitokondriers størrelse - f.eks. Alzheimers eller Parkinsons sygdom. Ud over, da mitokondrier, der er for små eller for store, potentielt kan føre til uhelbredelige sygdomme, det er tænkeligt, at de proteiner, der er ansvarlige for denne proces, kan være potentielle mål for fremtidige terapier.
Undersøgelsen blev offentliggjort i ACS Central Science og blev ledet af UCLA bioingeniørprofessor Gerard Wong.
Inde i cellen, mitokondrier ligner de lange balloner, der bruges til at skabe ballondyr. Hvis mitokondrierne er for lange, de kan blive viklet ind. Deres størrelse er kendt for at være primært reguleret af to proteiner, hvoraf den ene opdeler længere mitokondrier i mindre størrelser. De er kendt som cellernes "kraftværker", da de omdanner kemisk energi fra mad til en form, der er nyttig for celler til at udføre alle deres funktioner.
At holde mitokondrier i optimale størrelser er vigtigt for cellernes sundhed. En utilstrækkelig mængde af det regulerende protein, kendt som Dnm1, resulterer i, at mitokondrierne bliver for lange og sammenfiltrede. For meget Dnm1 resulterer i for mange korte mitokondrier. I begge tilfælde mitokondrierne gøres i det væsentlige ineffektive som strømforsyninger til cellen. Denne situation kan føre til neuroudviklingsforstyrrelser eller neurodegenerative sygdomme, som Alzheimers eller Parkinsons.
For bedre at forstå denne mekanisme, forskerne brugte en maskinlæringstilgang, de udviklede i 2016, til at finde ud af præcis, hvordan proteinerne opdeler en mitrokondrion i to mindre. De brugte også en kraftfuld teknik kaldet "synchrotron small-angle X-ray scattering" ved Stanford Synchrotron Radiation Lightsource, et forskningsanlæg fra det amerikanske energiministerium, for at se, hvordan disse proteiner deformerer mitokondriemembraner under denne proces.
Før denne undersøgelse, man troede, at disse proteiner omringede mitokondrierne, skær den derefter i to ved blot at klemme den godt sammen. Processen, holdet opdagede, er mere subtil.
"Når Dnm1 vikler sig om mitokondrier, det har tidligere vist sig, at proteinet fysisk strammer og klemmer, " sagde Michelle Lee, en nylig UCLA bioingeniør doktorgraduat, som blev rådgivet af Wong og er en af to hovedforfattere af undersøgelsen. "Det, vi fandt, er, at når Dnm1 kommer i kontakt med mitokondrieoverfladen, det gør også det område af mitokondriet selv mere formbart og lettere at gennemgå spaltning. Disse to effekter arbejder hånd i hånd for at gøre processen med mitokondriedeling effektiv."
Den anden hovedforfatter er Ernest Lee, en kandidatstuderende i UCLA-Caltech Medical Scientist Training Program og en bioingeniørstuderende også rådgivet af Wong. Han udførte de beregningsmæssige analyser til eksperimentet.
"Ved at bruge vores maskinlæringsværktøj, vi var i stand til at opdage skjult membranombygningsaktivitet i Dnm1, i overensstemmelse med vores røntgenundersøgelser, " sagde Lee. "Interessant nok, ved at analysere fjerne slægtninge til Dnm1, vi fandt ud af, at proteinet gradvist udviklede denne evne over tid."
"Dette er et meget uventet resultat - ingen troede, at disse molekyler ville have en splittet personlighed, med begge personligheder, der er nødvendige for den biologiske funktion, " sagde Wong, som også er UCLA-professor i kemi og biokemi og er medlem af California NanoSystems Institute. "Den multifunktionelle adfærd, vi identificerede, kan være reglen snarere end undtagelsen for proteiner."
 Varme artikler
Varme artikler
-
 Samme gen, forskellige parringsteknikker hos fluerParringsadfærdens trin i Drosophila subobscura inkludere tapning (A1), saks (A2), mellembenssving (A3), snabel forlængelse (A4), bryllupsgave (A5), vingeforlængelse (A6) og forsøg på kopulation (A7)
Samme gen, forskellige parringsteknikker hos fluerParringsadfærdens trin i Drosophila subobscura inkludere tapning (A1), saks (A2), mellembenssving (A3), snabel forlængelse (A4), bryllupsgave (A5), vingeforlængelse (A6) og forsøg på kopulation (A7) -
 Hvad er fordele og ulemper ved at være endotermisk?Endotermiske dyr er mere almindeligt kendt som varmblodige. Udtrykket varmblodet er lidt af en fejlnummer, fordi koldblodede dyr også har varmt blod; de er imidlertid “ektotermiske.” Den vigtigste
Hvad er fordele og ulemper ved at være endotermisk?Endotermiske dyr er mere almindeligt kendt som varmblodige. Udtrykket varmblodet er lidt af en fejlnummer, fordi koldblodede dyr også har varmt blod; de er imidlertid “ektotermiske.” Den vigtigste -
 Mødres alder påvirker genetisk lighed mellem tvillingerCaenorhabditis elegans orm med fluorescerende æggeblomme og embryoner indeni. Kredit:Lola Davey, Marcos Francisco Perez, CRG Påvirker en mors alder træk og egenskaber ved hendes afkom, og hvor? Et
Mødres alder påvirker genetisk lighed mellem tvillingerCaenorhabditis elegans orm med fluorescerende æggeblomme og embryoner indeni. Kredit:Lola Davey, Marcos Francisco Perez, CRG Påvirker en mors alder træk og egenskaber ved hendes afkom, og hvor? Et -
 Forskere afslører fejlsikker struktur af enzym knyttet til Alzheimers, KræftLigesom millioner af amerikanere, Postdoc ved Harvard Medical School, Tom Seegar, kæmpede, da han så flere familiemedlemmer falde fra Alzheimers sygdom. At se dem begynde at miste det, vi værdsætter
Forskere afslører fejlsikker struktur af enzym knyttet til Alzheimers, KræftLigesom millioner af amerikanere, Postdoc ved Harvard Medical School, Tom Seegar, kæmpede, da han så flere familiemedlemmer falde fra Alzheimers sygdom. At se dem begynde at miste det, vi værdsætter
- Nanoteknologi kan føre til ny behandling af leverkræft
- 100-års oversvømmelser vil ske hvert 1. til 30. år, ifølge nye oversvømmelseskort
- Hvordan dashcams hjælper og hindrer retsmedicin
- Afvigende hyfer udløst af værtens immunrespons på plantepatogen svamp
- En ny undersøgelse udforsker humor i ordindlejringer
- Forskeren udviklede 3D-scanninger af biller til Blade Runner 2049


