Forskere kortlægger narkotiske genomiske mål i udviklingen af malariaparasit
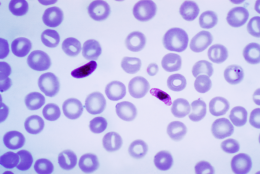
Dette mikrofotografi af en blodudstrygning indeholder en makro- og mikrogametocyt af parasitten Plasmodium falciparum. Kredit:Wikipedia.
Forskere ved University of California San Diego School of Medicine, med kolleger i hele landet og rundt om i verden, har brugt hele genomanalyser og kemogenetik til at identificere nye lægemiddelmål og resistensgener i 262 parasitcellelinjer af Plasmodium falciparum —Protozoiske patogener, der forårsager malaria - der er resistente over for 37 forskellige malariaforbindelser.
Studiet, udgivet i 12. januar -udgaven af Videnskab , bekræftet tidligere kendte genetiske modifikationer, der i væsentlig grad bidrager til parasittenes lægemiddelresistens, men afslørede også nye mål, der uddyber forståelsen af parasittenes underliggende biologi.
"Denne udforskning af P. falciparum resistome-indsamlingen af antibiotikaresistensgener-og dets lægemiddel-kompatible genom vil hjælpe med at guide nye lægemiddelopdagelsesbestræbelser og fremme vores forståelse af, hvordan malariaparasitten udvikler sig til at kæmpe tilbage, "sagde seniorforfatter Elizabeth Winzeler, Ph.d., professor i farmakologi og opdagelse af lægemidler i Institut for Pædiatri ved UC San Diego School of Medicine.
P. falciparum er et encellede protozoer, der overføres til mennesker gennem bid af inficerede Anopheles -myg. Det er ansvarligt for cirka halvdelen af alle malariatilfælde. Malarias massivt uforholdsmæssige indvirkning på menneskers sundhed - Verdenssundhedsorganisationen anslår, at der var 216 millioner tilfælde verden over og 445, 000 dødsfald i 2016 - skyldes dels parasittenes særlige evne til at skifte genom for at undgå og modstå lægemiddelbehandling og det menneskelige immunsystem.
"En enkelt menneskelig infektion kan resultere i, at en person indeholder op mod en billion aseksuelle blodstadieparasitter, "sagde Winzeler." Selv med en relativt langsom tilfældig mutationsrate, disse tal giver ekstraordinær tilpasningsevne. På få replikationscykler, det P. falciparum genom kan erhverve en tilfældig genetisk ændring, der kan gøre mindst én parasit resistent over for aktiviteten af et lægemiddel eller et menneskekodet antistof. "
Sådan hurtig udvikling udgør betydelige udfordringer for at kontrollere sygdommen, sagde forskere, men det kan også udnyttes in vitro at dokumentere præcist, hvordan parasitten udvikler sig i nærvær af kendte antimalarialer for at skabe lægemiddelresistens. Det kan også bruges til at afsløre nye lægemiddelmål.
Frem for at fokusere på parasiters interaktion med enkeltforbindelser eller undersøge enkelt mistænkte gener i P. falciparum , Winzeler og kolleger brugte hele genom -sekventering og et mangfoldigt sæt antimalarialforbindelser. Det resulterende datasæt afslørede en mangfoldighed af mutationer. Resistente parasitter indeholdt ofte en mutation i et formodet målgen og yderligere mutationer i andre, urelaterede gener.
"Vores resultater viste og understregede den udfordrende kompleksitet af udviklet lægemiddelresistens i P. falciparum , "sagde Winzeler, "men de identificerede også nye lægemiddelmål eller resistensgener for hver forbindelse, for hvilken resistente parasitter blev genereret. Det afslørede det komplicerede kemogenetiske landskab af P. falciparum , men gav også en potentiel vejledning til design af nye småmolekylehæmmere til bekæmpelse af dette patogen. "
 Varme artikler
Varme artikler
-
 Trofæjagt kan forårsage udryddelse i et foranderligt miljøKredit:CC0 Public Domain Trofæjagt og andre aktiviteter, der involverer målretning mod handyr af høj kvalitet, kan føre til udryddelse af visse arter, der står over for skiftende miljøforhold, ifø
Trofæjagt kan forårsage udryddelse i et foranderligt miljøKredit:CC0 Public Domain Trofæjagt og andre aktiviteter, der involverer målretning mod handyr af høj kvalitet, kan føre til udryddelse af visse arter, der står over for skiftende miljøforhold, ifø -
 Australsk politi jager morder af kæmpe krokodilleEn 5,2 meter lang hankrokodille blev fundet i Queensland, Australien med et enkelt skudsår i hovedet, satte gang i en jagt på morderen En menneskejagt er begyndt på morderen af en kæmpe saltvand
Australsk politi jager morder af kæmpe krokodilleEn 5,2 meter lang hankrokodille blev fundet i Queensland, Australien med et enkelt skudsår i hovedet, satte gang i en jagt på morderen En menneskejagt er begyndt på morderen af en kæmpe saltvand -
 Tilpasning til svingende temperaturerConstantin Zohner bestemmer tidspunktet for klorofylnedbrydning i bladene. Kredit:C. Zohner Vegetationens varighed - det vil sige den tid, der går mellem at bladre ud (forekomsten af det første
Tilpasning til svingende temperaturerConstantin Zohner bestemmer tidspunktet for klorofylnedbrydning i bladene. Kredit:C. Zohner Vegetationens varighed - det vil sige den tid, der går mellem at bladre ud (forekomsten af det første -
 Forskere finder, at skorpioner målretter deres giftDr. Jamie Seymour fra JCUs Australian Institute of Tropical Health and Medicine (AITHM) sagde, at et typisk skorpion-rovdyr ville være et lille pattedyr. mens dens bytte normalt var et insekt. Han sag
Forskere finder, at skorpioner målretter deres giftDr. Jamie Seymour fra JCUs Australian Institute of Tropical Health and Medicine (AITHM) sagde, at et typisk skorpion-rovdyr ville være et lille pattedyr. mens dens bytte normalt var et insekt. Han sag
- Kometer bidrog til jordens atmosfære, siger undersøgelse af 3 milliarder år gamle mineraler
- Ny klasse af materialer viser mærkelige elektronegenskaber
- Beskyttelse af søgræs er nøglen til at opbygge modstandsdygtighed over for klimaændringer og kat…
- Sådan fungerer Deep Underground Neutrino -eksperimentet
- Inkjet-printere kan producere billige mikrobølgeledere til optiske computere
- Den gamle thebanske havn Chalcis - et middelalderligt maritimt korsvej i Grækenland


