Forskere opdager dual-function messenger RNA
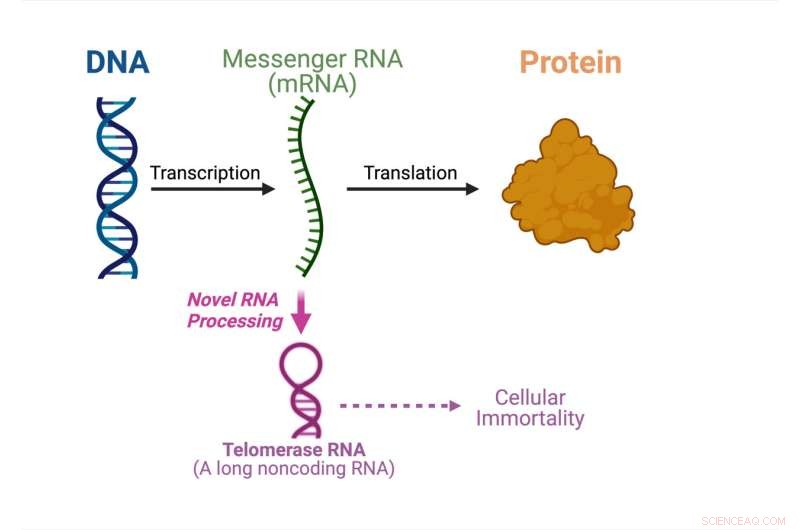
Molekylærbiologiens centrale dogme viser, hvad der sker i denne undersøgelse. Kredit:Julian Chen
For allerførste gang har en undersøgelse ledet af Julian Chen og hans gruppe i Arizona State University's School of Molecular Sciences og Biodesign Institute's Center for the Mechanism of Evolution opdaget en hidtil uset vej, der producerer telomerase-RNA fra et proteinkodende messenger-RNA ( mRNA).
Molekylærbiologiens centrale dogme specificerer den rækkefølge, hvori genetisk information overføres fra DNA for at lave proteiner. Messenger-RNA-molekyler bærer den genetiske information fra DNA'et i cellens kerne til cytoplasmaet, hvor proteinerne er lavet. Messenger RNA fungerer som budbringeren til at bygge proteiner.
"Faktisk er der mange RNA'er (ribonukleinsyrer), der ikke bruges til at lave proteiner," forklarede Chen. "Omkring 70 procent af det menneskelige genom bruges til at lave ikke-kodende RNA'er, der ikke koder for proteinsekvenser, men har andre anvendelser."
Telomerase-RNA er et af de ikke-kodende RNA'er, der samles sammen med telomeraseproteiner for at danne enzymet telomerase. Telomerase er afgørende for cellulær udødelighed i cancer og stamceller. I denne undersøgelse viser Chens gruppe, at et svampetelomerase-RNA behandles fra et proteinkodende mRNA i stedet for at blive syntetiseret uafhængigt.
"Vores fund fra dette papir er paradigmeskiftende. De fleste RNA-molekyler syntetiseres uafhængigt, og her afslørede vi et dobbeltfunktions-mRNA, der kan bruges til at producere et protein eller til at lave et ikke-kodende telomerase-RNA, som er virkelig unikt," sagde Chen. "Vi bliver nødt til at forske meget mere for at forstå den underliggende mekanisme bag sådan en usædvanlig RNA-biogenese-vej."
Grundforskning i metabolisme og regulering af mRNA har ført til vigtige medicinske anvendelser. For eksempel bruger flere COVID-19-vacciner messenger-RNA som et middel til at producere virale spikeproteiner. I disse vacciner bliver mRNA-molekylerne til sidst nedbrudt og derefter absorberet af vores kroppe.
Denne nye tilgang har fordele i forhold til DNA-vacciner, som løber en potentiel risiko for at blive skadeligt og permanent inkorporeret i vores DNA. Opdagelsen af dobbeltfunktions mRNA-biogenese i dette arbejde kan føre til innovative måder at fremstille fremtidige mRNA-vacciner på.
I denne undersøgelse opdagede Chens gruppe det uventede mRNA-afledte telomerase-RNA i svampemodellen Ustilago maydis eller majssmud. Corn smut, også kaldet mexicansk trøffel, er spiselig og tilføjer en lækker umami-effekt til mange retter, for eksempel tamales og tacos. Studiet af RNA og telomerbiologi i majssmut kan give muligheder for at finde nye mekanismer for mRNA-metabolisme og telomerasebiogenese.
Hvorfor studere telomerase-RNA?
Nobelprisen i fysiologi eller medicin blev tildelt i 2009 "for opdagelsen af, hvordan kromosomer er beskyttet af telomerer og enzymet telomerase." Telomerase blev først isoleret fra en encellet organisme, der levede i damskum. Som det senere viste sig, findes telomerase i næsten alle eukaryote organismer, inklusive mennesker, og spiller en afgørende rolle i aldring og kræft. Forskere har forsøgt at finde måder at bruge telomerase til at gøre menneskelige celler udødelige.
Typiske menneskelige celler er dødelige og kan ikke for evigt forny sig selv. Som demonstreret af Leonard Hayflick for et halvt århundrede siden, har menneskelige celler en begrænset replikativ levetid, hvor ældre celler når denne grænse hurtigere end yngre celler. Denne "Hayflick-grænse" for cellulære levetid er direkte relateret til antallet af unikke DNA-gentagelser fundet i enderne af de genetiske materiale-bærende kromosomer. Disse DNA-gentagelser er en del af de beskyttende afdækningsstrukturer, kaldet "telomerer", som beskytter enderne af kromosomerne mod uønskede og uberettigede DNA-omlejringer, der destabiliserer genomet.
Hver gang cellen deler sig, krymper det telomere DNA og vil til sidst ikke sikre kromosomenderne. Denne kontinuerlige reduktion af telomerlængde fungerer som et "molekylært ur", der tæller ned til slutningen af cellevækst.
Den formindskede evne for celler til at vokse er stærkt forbundet med aldringsprocessen, hvor den reducerede cellepopulation direkte bidrager til svaghed, sygdom og organsvigt.
Telomerase, der modvirker telomer-krympningsprocessen, er enzymet, der entydigt holder nøglen til at forsinke eller endda vende den cellulære ældningsprocessen. Telomerase udligner cellulær aldring ved at forlænge telomererne, tilføje tabte DNA-gentagelser tilbage for at tilføje tid til den molekylære ur-nedtælling, hvilket effektivt forlænger cellens levetid.
Telomerase forlænger telomerer ved gentagne gange at syntetisere meget korte DNA-gentagelser af seks nukleotider – byggestenene i DNA – med sekvensen "GGTTAG" på kromosomenderne fra en skabelon placeret i RNA-komponenten af selve enzymet.
Den gradvise krympning af telomerer påvirker negativt den replikative kapacitet af menneskelige stamceller, de celler, der genopretter beskadiget væv og/eller genopbygger aldrende organer i vores kroppe. Aktiviteten af telomerase i voksne stamceller sænker blot nedtællingen af det molekylære ur og udødeliggør ikke disse celler fuldstændigt. Derfor bliver voksne stamceller udmattede hos ældre individer på grund af telomerlængdeforkortelse, hvilket resulterer i øgede helingstider og organvævsnedbrydning fra utilstrækkelige cellepopulationer.
Udnyttelse af telomerasens fulde potentiale
Forståelse af reguleringen og begrænsningen af telomerase-enzymet har løftet om at vende telomerforkortelse og cellulær aldring med potentiale til at forlænge menneskets levetid og forbedre velvære hos ældre individer.
Menneskelige sygdomme, der inkluderer dyseratosis congenita, aplastisk anæmi og idiopatisk lungefibrose, er blevet genetisk forbundet med mutationer, der negativt påvirker telomeraseaktiviteten og/eller fremskynder tabet af telomerlængde. Denne accelererede telomerforkortning minder meget om for tidlig aldring med øget organforringelse og en forkortet patientlevetid forårsaget af kritisk utilstrækkelige stamcellepopulationer. Øget telomeraseaktivitet er tilsyneladende det mest lovende middel til behandling af disse genetiske sygdomme.
Mens øget telomeraseaktivitet kan bringe unge til aldrende celler og helbrede for tidlig ældningslignende sygdomme, kan for meget af det gode være skadeligt for individet. Ligesom ungdommelige stamceller bruger telomerase til at opveje tab af telomerlængde, anvender kræftceller telomerase til at opretholde deres afvigende og destruktive vækst. Forøgelse og regulering af telomerasefunktionen skal udføres med præcision, idet man går en snæver linje mellem celleforyngelse og en øget risiko for kræftudvikling.
Til forskel fra menneskelige stamceller udgør somatiske celler langt størstedelen af cellerne i den menneskelige krop og mangler telomeraseaktivitet. Menneskelige somatiske cellers telomerasemangel reducerer risikoen for kræftudvikling, da telomerase fremmer ukontrolleret kræftcellevækst. Derfor er lægemidler, der øger telomeraseaktivitet vilkårligt i alle celletyper, ikke ønsket. Lægemidler med små molekyler kan screenes eller designes til at øge telomeraseaktivitet udelukkende i stamceller til sygdomsbehandling såvel som antialdringsterapier uden at øge risikoen for kræft.
Studiet af telomerase-RNA-biogenese i majssmut kan afsløre nye mekanismer til telomeraseregulering og tilbyde nye retninger for, hvordan man modulerer eller konstruerer human telomerase til innovationer inden for udvikling af antialdrings- og anticancerterapi.
Denne undersøgelse, "Biogenesis of telomerase RNA from a protein-coding mRNA precursor," blev netop offentliggjort i Proceedings of the National Academy of Sciences . ASU-teamet omfatter førsteforfattere postdoc Dhenugen Logeswaran og tidligere forskningsassistent professor Yang Li, doktorand Khadiza Akhter, tidligere postdoc Joshua Podlevsky (i øjeblikket ved Sandia National Labs, Albuquerque, New Mexico) og to bachelorstuderende Tamara Olson og Katherine Fosberg.
Chen kommenterede også kaliberen af ASU-studerende, Tamara Olson og Katherine Fosberg, som arbejdede i hans laboratorium i over et år. "De brugte meget tid i laboratoriet og var fuldt ud involveret i vores forskning." + Udforsk yderligere
Hvad hummere kan lære os om udødelighed
 Varme artikler
Varme artikler
-
 Undersøgelse viser, at kommerciel høst af snappede skildpadder fører til fald i befolkningenBen Colteaux, Ph.d., i Integrative Life Sciences-programmet holder en snappende skildpadde i marken. Kredit:Hilsen af Team Snapper At kravle gennem nakkehøjt mudder på flodbredder er et beskidt
Undersøgelse viser, at kommerciel høst af snappede skildpadder fører til fald i befolkningenBen Colteaux, Ph.d., i Integrative Life Sciences-programmet holder en snappende skildpadde i marken. Kredit:Hilsen af Team Snapper At kravle gennem nakkehøjt mudder på flodbredder er et beskidt -
 Fem trin til at forberede Agar skråAgar er et gelélignende stof, der stammer fra rensede cellevægge af røde alger. Det sættes til mikrobiologiske medier, som er materialer, hvorpå mikroorganismer dyrkes i laboratorier, for at give s
Fem trin til at forberede Agar skråAgar er et gelélignende stof, der stammer fra rensede cellevægge af røde alger. Det sættes til mikrobiologiske medier, som er materialer, hvorpå mikroorganismer dyrkes i laboratorier, for at give s -
 Undersøgelse advarer om, at slangesvampesygdom kan være en global trusselmælkeslange ( Lampropeltis triangulum ) viser tegn på svampe- og bakterieinfektioner. Kredit:© USGS National Wildlife Health Center/D.E. Grøn Ny forskning tyder på, at en potentielt dødelig slan
Undersøgelse advarer om, at slangesvampesygdom kan være en global trusselmælkeslange ( Lampropeltis triangulum ) viser tegn på svampe- og bakterieinfektioner. Kredit:© USGS National Wildlife Health Center/D.E. Grøn Ny forskning tyder på, at en potentielt dødelig slan -
 Auxin driver bladudfladningKonceptuel model af, hvordan rumlig auxin-signalering styrer bladmønster. Kredit:IGDB Langt de fleste højere planter bruger blade til at høste solenergi. Et almindeligt træk ved blade er deres fla
Auxin driver bladudfladningKonceptuel model af, hvordan rumlig auxin-signalering styrer bladmønster. Kredit:IGDB Langt de fleste højere planter bruger blade til at høste solenergi. Et almindeligt træk ved blade er deres fla
- FORKLARER:Hvad er nogle vigtige beslutninger i forbindelse med bekæmpelse af brande?
- En ny grøn løsning til farvning af blå denim
- Amerikanske klimaskeptikere sender rystelser gennem arktisk samarbejde
- Hvordan Canada kunne drage fordel af et CO2-budget
- Virtuelt laboratorium finder det rigtige AI-værktøj til hvert kemiproblem
- Pakis tektonik afslører Venus geologiske hemmeligheder


