To nye opdagelser kaster lys over mysteriet om, hvordan celler håndterer stress
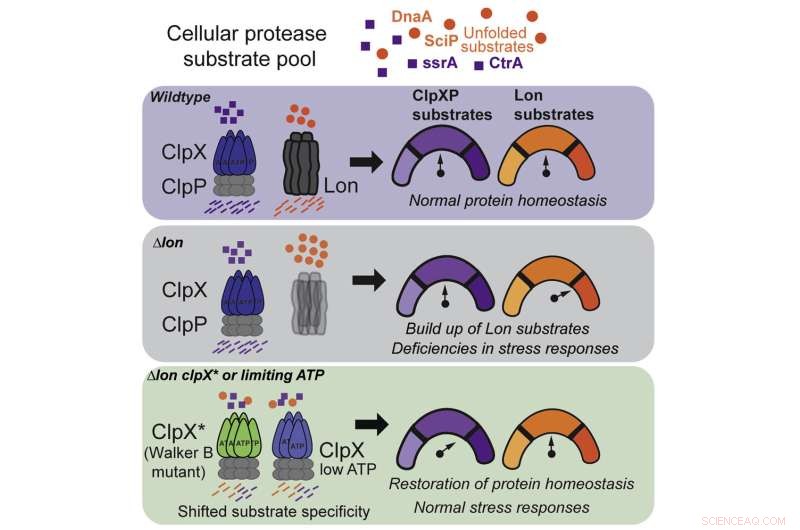
Kredit:Samar A. Mahmoud et al., Cell Reports (2022). DOI:10.1016/j.celrep.2022.111405
I ny forskning for nylig offentliggjort i tidsskriftet Cell Reports , et team af forskere fra University of Massachusetts Amherst dykkede ned i mysterierne om, hvordan celler modstår stress. Ved hjælp af bakterieceller opdagede forskerne, at et skade-reparerende enzym, kaldet ClpX, ikke kun kan mutere for at løse flere cellulære problemer, men kan reagere på skiftende niveauer af cellulær energi for at hjælpe med at holde en celle sund.
"Det, vi virkelig er interesserede i," siger Peter Chien, professor i biokemi og molekylærbiologi ved UMass Amherst og avisens seniorforfatter, "er, hvordan celler reagerer på stress. Vi studerer en klasse af enzymer, kaldet proteaser, som målretter og ødelægge skadelige proteiner i en celle. Disse proteaser kan selektivt genkende specifikke, individuelle proteiner enestående proteiner. Men hvordan gør de dette? Hvordan kan de vælge mellem sunde og skadelige proteiner?"
For at besvare dette spørgsmål fokuserede Chien og hans medforfattere på to specifikke proteaser, kendt som Lon og ClpX, som hver især er udsøgt indstillet til at genkende et andet skadeligt protein. Man havde længe troet, at Lon og ClpX fungerede som nøgler:Hver enkelt kunne kun åbne en bestemt lås og ingen anden, og hvis en celle manglede enten, ville der opstå alvorlige bivirkninger.
"Hvis du nogensinde har haft en ekstremt rodet studiekammerat," siger Chien, "ved du, hvor vigtigt det er at tømme skraldespanden regelmæssigt. At savne Lon-proteasen er som at have en værelseskammerat, der aldrig vasker, skifter eller gør rent."
Men efter en række eksperimenter, der involverede sletning af Lon fra kolonier af bakterieceller, begyndte Chiens team at bemærke noget mærkeligt:Nogle af kolonierne overlevede.
Denne observation førte til deres første opdagelse:ClpX kan mutere for at udføre en Lon-lignende funktion, selvom den mister nogle af sine ClpX-evner. Det er, som om du for at holde dit kollegieværelse rent, begyndte at vaske din værelseskammerats sokker, men var nødt til at ofre noget af dit eget rene vasketøj for at gøre det.
Ved at finde ud af præcis, hvordan ClpX-mutationen tillod proteasen at udvide sin funktion, gjorde holdet sin anden opdagelse:Vild, ikke-mutant ClpX kan også udføre nogle af Lons pligter under de rette betingelser.
Det viser sig, at ClpX er meget følsom over for ATP, en organisk forbindelse, der er energikilden for alle levende celler. Ved normale niveauer af ATP fokuserer ClpX på sine egne opgaver, men ved en specifik, lavere tærskel begynder det pludselig at rydde op efter Lon.
"Dette er et reelt gennembrud i den grundlæggende forståelse af, hvordan celler fungerer," siger Chien. "Det ændrer reglerne:Ikke kun styrer cellulær energi, hvor hurtigt en celle virker, men også hvordan den fungerer." + Udforsk yderligere
ClpX-ClpP proteinkompleks kunne være udgangspunktet for nye antibiotika
 Varme artikler
Varme artikler
-
 Sådan fungerer ekstremofilerHalofiler, som trives i super salte miljøer, og metanogener, som lever på steder som dyretarm, er begge hårde encellede organismer kaldet ekstremofiler. Billede med tilladelse fra Maryland Astrobiolog
Sådan fungerer ekstremofilerHalofiler, som trives i super salte miljøer, og metanogener, som lever på steder som dyretarm, er begge hårde encellede organismer kaldet ekstremofiler. Billede med tilladelse fra Maryland Astrobiolog -
 Forklaring af cellespecialiseringCellespecialisering, også kendt som celledifferentiering, er den proces, hvor generiske celler ændres til specifikke celler, der er beregnet til at udføre visse opgaver i kroppen. Celle-specialisering
Forklaring af cellespecialiseringCellespecialisering, også kendt som celledifferentiering, er den proces, hvor generiske celler ændres til specifikke celler, der er beregnet til at udføre visse opgaver i kroppen. Celle-specialisering -
 Disse spidser har hoveder, der krymper med sæsonenFoto af den almindelige spidsmus Sorex araneus . Kredit:Karol Zub Hvis en del af kroppen ser ud til at være dårligt udstyret til at krympe, det ville sandsynligvis være hoved og kranium. Og, end
Disse spidser har hoveder, der krymper med sæsonenFoto af den almindelige spidsmus Sorex araneus . Kredit:Karol Zub Hvis en del af kroppen ser ud til at være dårligt udstyret til at krympe, det ville sandsynligvis være hoved og kranium. Og, end -
 BigH1 - nøglehistonen for mandlig fertilitetI rødt, BigH1 udtrykt i kimstamceller og spermatocytter. I blåt, cellekernerne. Kredit:Albert Carbonell, IRB Barcelona. Forskere i Chromatin Structure and Function Lab ved Institute for Research i
BigH1 - nøglehistonen for mandlig fertilitetI rødt, BigH1 udtrykt i kimstamceller og spermatocytter. I blåt, cellekernerne. Kredit:Albert Carbonell, IRB Barcelona. Forskere i Chromatin Structure and Function Lab ved Institute for Research i
- Forskere afslører unikke egenskaber ved en lovende ny superleder
- Irriterende forurenende stoffer, der vedvarer, høflighed af naturen
- Sådan beregner du gallonerne per kubisk fod
- Hvordan vil mennesker tilpasse sig klimaforandringerne? Spørg en viking
- Tilstedeværelse, persistens af østrogener i forårspuljer er en ny bekymring
- Apple TV Plus lanceres på fredag med laveste pris for større abonnementstjenester


