Indsigt i mekanismen bag ultraviolet lysskade og kræftlæsioner kan bidrage til kræftbehandling
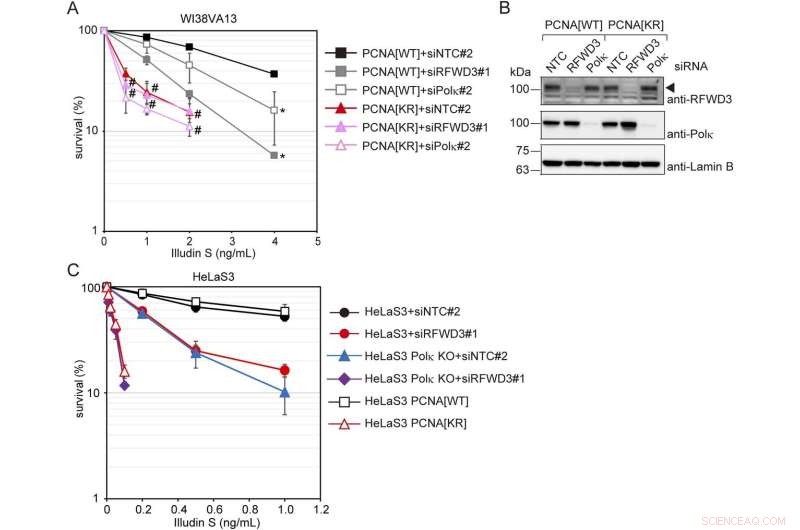
RFWD3- og Polκ-medierede DNA-skadetoleranceveje er uafhængige af hinanden, men begge er afhængige af PCNA-modifikationer ved K164. (A) PCNA[WT]- og [KR]-celler blev transficeret med siRFWD3#1, siPolκ#2 eller siNTC#2. Celler blev udsat for illudin S i 4 dage og analyseret ved MTS-assay. Data er repræsenteret som middel ± SD af n =4 uafhængige eksperimenter. *P <0,05 versus siNTC#2; #, ikke signifikant i forhold til siNTC#2. (B) Helcellelysater fra cellerne under anvendelse af (A) blev fremstillet og analyseret ved immunblotting under anvendelse af anti-RFWD3, anti-Polk og anti-Lamin B1 antistoffer. Pilespidsen viser RFWD3-signalet. (C) HeLaS3 og HeLaS3 Polκ KO-celler blev transficeret med siRFWD3#1 eller siNTC#2 og udsat for illudin S i 4 dage. HeLaS3 PCNA[WT] eller PCNA[KR] celler blev udsat for illudin S i 4 dage. Cellulær overlevelse blev evalueret ved MTS-assay. Data er repræsenteret som middel ± SD af n =4 (HeLaS3+siNTC#2, HeLaS3+siRFWD3#2 og HeLaS3 Polκ KO+siNTC#2) eller n =3 (HeLaS3 Polκ KO+siRFWD3#1, HeLaS3 PCNA[WT ], og PCNA[KR]) uafhængige eksperimenter. Statistisk signifikans blev evalueret ved tosidet t-test. Kredit:Life Science Alliance (2022). DOI:10.26508/lsa.202201584
Et hold ledet af forskere fra Nagoya University i Japan har opdaget nye veje, som celler bruger til at reparere sig selv efter eksponering for ultraviolet (UV) lys, og et nyt middel involveret i disse veje kendt som RFWD3. Dette kan føre til fremtidige behandlinger for mennesker med lysfølsomme sygdomme og tilskynde til udvikling af bedre medicin mod kræft. "Vi mener, at vores resultater giver et nyt perspektiv til området for DNA-skaderespons og også til cellebiologi," sagde hovedforfatter, Chikahide Masutani. De offentliggjorde deres forskning i tidsskriftet Life Science Alliance .
På samme måde som vores krop får snitsår og skrammer, mens vi går gennem livet, kan DNA også opretholde små stykker kumulativ skade. En almindelig form for sådan skade er en DNA-læsion. Eksponering for UV-lys kan f.eks. få en del af DNA til at indeholde et beskadiget sted eller ændre et af dets par. Sagt på en anden måde kan vi tænke på DNA som en skrevet sætning. I en sætning ville en DNA-læsion være som et forkert trykt ord, hvilket gør det ulæseligt. På samme måde som udskrivning af en række bøger inklusive fejltrykte ord gør alle bøgerne ulæselige, kan en DNA-læsion gøre hele genomet ustabilt eller forårsage permanente mutationer, når det kopieres. Disse læsioner er vigtige, fordi de er forbundet med mange former for kræft.
For at modvirke virkningerne af en DNA-læsion har menneskekroppe flere DNA-skadetoleranceveje. Disse veje muliggør replikation selv i nærvær af læsioner. Derfor har biologer søgt at identificere de faktorer, der er involveret i uidentificerede DNA-skadetolerancemekanismer.
Især en sådan faktor er prolifererende cellekerneantigen (PCNA). PCNA aktiverer translæsions-DNA-syntese, som reparerer læsioner ved hjælp af enzymet DNA-polymerase eta (Pol-eta). Selvom denne vej er interessant, fordi den giver celler modstand mod UV-bestråling og nogle DNA-skadelige midler, kan andre veje også være vigtige, især de veje, der er uafhængige af Pol-eta.
En gruppe forskere fra Nagoya University, ledet af Rie Kanao og Chikahide Masutani fra Research Institute of Environmental Medicine, har opdaget nye midler ved bevidst at skabe læsioner ved hjælp af illudin S, et svampetoksin og dets derivat irofulven. Forskerne fandt, at celler uden PCNA-modifikation var følsomme over for disse forbindelser, hvilket forårsagede læsioner. På den anden side var de, der manglede Pol-eta, det ikke. Derfor kunne de analysere den PCNA-modifikationsafhængige vej for læsionsreparation uafhængigt af Pol-eta-vejen.
Kanao og Masutani identificerede, at midlerne i den PCNA-modifikationsafhængige vej inkluderer RFWD3, et proteinkodende gen. RFWD3 er fælles for begge veje, derfor tyder dette på, at de to hovedgrene af pathwayen er Pol-eta og RFWD3 for læsioner forårsaget af UV-lys, og polymerase kappa og RFWD3 for dem forårsaget af illudin S. "Det kan være et generelt træk. at forskellige DNA-polymeraser anvendes afhængigt af typen af DNA-læsion," forklarede Masutani. "Vores resultater tyder på, at RFWD3 bidrager til PCNA-modifikationsafhængig DNA-skadetolerance. Dette er den første beskrivelse af involveringen af RFWD3 i UV-overlevelse i humane celler."
En lovende anvendelse af denne forskning er til anticancerbehandling, fordi det kan blive muligt at hæmme DNA-skadetoleranceveje. Selvom DNA-skadetolerance formodes at hjælpe med at reparere læsioner, bruger kræftformer nogle gange midlerne til at hjælpe dem med at tolerere DNA-skadelige anti-cancer-lægemidler. "Vi tror på, at forskningen kan bidrage til kræftbehandling," sagde Masutani. "Der er stigende beviser for, at vi ved at hæmme DNA-skadetolerance-veje kan sensibilisere kræftceller over for konventionelle kemoterapeutiske midler. Mere forskning i nye terapeutiske midler på dette område kan i sidste ende føre til udviklingen af en ny klasse af kræftterapeutiske midler, der forbedrer respons på behandling ved hjælp af konventionel kemoterapi." + Udforsk yderligere
DNA-replikation under mikroskopet
 Varme artikler
Varme artikler
-
 Hvad gør en chimpanse opbrugt?Chimpanse, der spiser en appelsin. Kredit:Cecile Sarabian, HJÆLP Congo, Kyoto Universitet Chimpanser gør nogle ret ulækre ting. I deres naturlige levesteder, chimpanser er kendt for at opsamle fr
Hvad gør en chimpanse opbrugt?Chimpanse, der spiser en appelsin. Kredit:Cecile Sarabian, HJÆLP Congo, Kyoto Universitet Chimpanser gør nogle ret ulækre ting. I deres naturlige levesteder, chimpanser er kendt for at opsamle fr -
 Tiår lang undersøgelse viser, at truede hvaler får færre børnKredit:Bridgette OShannessy Et forskningsprojekt i verdensklasse har fundet ud af, at den australske bestand af sydlige rethvaler kælver sjældnere, og færre hvaler besøgte Australiens kyster i denn
Tiår lang undersøgelse viser, at truede hvaler får færre børnKredit:Bridgette OShannessy Et forskningsprojekt i verdensklasse har fundet ud af, at den australske bestand af sydlige rethvaler kælver sjældnere, og færre hvaler besøgte Australiens kyster i denn -
 Undersøgelse tyder på, at ydmyg elritse kan tage varmenKredit:Pixabay/CC0 Public Domain Mennesker er ikke de eneste, der lider under hidtil usete hedebølger i et opvarmende klima. Overvej den ydmyge minnow. Disse små fisk repræsenterer den altafgørende
Undersøgelse tyder på, at ydmyg elritse kan tage varmenKredit:Pixabay/CC0 Public Domain Mennesker er ikke de eneste, der lider under hidtil usete hedebølger i et opvarmende klima. Overvej den ydmyge minnow. Disse små fisk repræsenterer den altafgørende -
 I kampen mod viral infektion, stavning tællerEn menneskelig celle (grøn) inficeret med HIV (rød). Kredit:Laboratory of Retrovirology ved Rockefeller University/Nature I millioner af år, mennesker og vira har engageret sig i et konstant tovtr
I kampen mod viral infektion, stavning tællerEn menneskelig celle (grøn) inficeret med HIV (rød). Kredit:Laboratory of Retrovirology ved Rockefeller University/Nature I millioner af år, mennesker og vira har engageret sig i et konstant tovtr
- Den subtropiske storm Andrea springer over pistolen som den første storm i Atlanterhavssæsonen 201…
- Sådan beregnes lyspolebasestørrelse
- Musk afleverer fremstillede i Kina Teslaer til tidlige købere i Shanghai
- Tidligere Tinder -direktør Sean Rad anklaget for hemmeligt at have registreret medarbejdere og chef…
- Instruktioner for et Galileo Termometer
- Rusland kræver, at Tinder giver data om sine brugere


