Molekylære tags afslører, hvordan beskadigede lysosomer udvælges og markeres til clearance
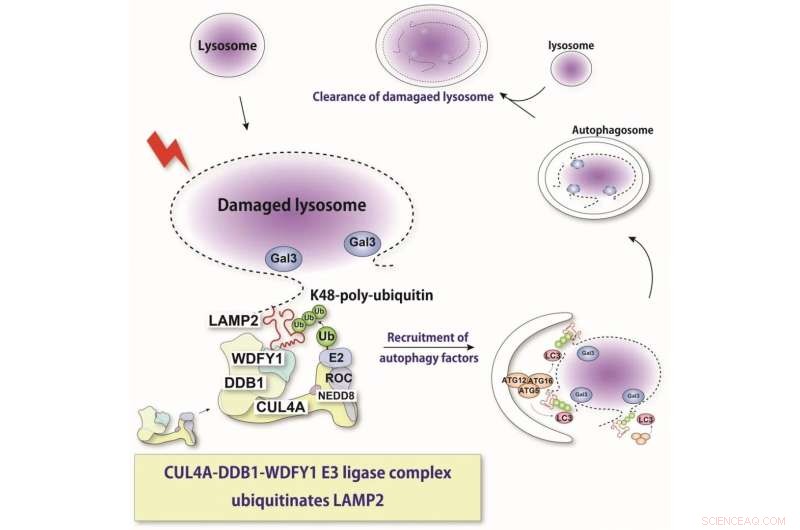
Lysosomet er en sur intracellulær organel, der er afgørende for nedbrydning af forskellige cellulære komponenter. Ved lysosomal membranbeskadigelse frigives lysosomale hydrolaser til cytosolen og inducerer stressreaktioner eller celledød. Her viser vi, at et nyligt identificeret proteinkompleks genkender beskadigede lysosomer og ubiquitinerer et substrat, LAMP2. Denne genkendelse inducerer selektiv autofagi. Kredit:Keisuke Tabata
Autofagi er en selvnedbrydningsproces, som celler bruger til at fjerne unødvendige eller beskadigede komponenter. Der er flere former for autofagi, herunder makroautofagi, som er et bulk-nedbrydningssystem, der bruges til at målrette materialer i cellens cytosol til organeller kaldet lysosomer til enzymatisk nedbrydning. Men selv lysosomer skal nogle gange nedbrydes. For nylig undersøgte Osaka University-forskere de specifikke molekylære detaljer om, hvordan beskadigede lysosomer udvælges og markeres til clearance.
I en nylig artikel offentliggjort i Cell Reports , beskrev holdet en proces kaldet lysofagi, den specifikke form for selektiv autofagi, der er ansvarlig for at fjerne beskadigede lysosomer. Tidligere undersøgelser har vist, at stoffer som toksiner, lipider og kolesterol eller uratkrystaller kan sprænge lysosomer. Ud over at gøre organellen dysfunktionel, kan denne skade også inducere oxidativt stress og betændelse, der kan føre til sygdomsudvikling. Derfor bruger cellen lysofagi til at løse dette. Imidlertid er mekanismerne, der styrer, hvordan celler kan genkende de beskadigede lysosomer og målrette dem til nedbrydning, ikke fuldt ud forstået.
"Vi ved fra tidligere undersøgelser, at lysosomer kan mærkes af et specifikt enzym, SCFFBXO27 gennem en proces kaldet polyubiquitinering," siger en af hovedforfatterne, Hirofumi Teranishi. "Ekspression af SCFFBXO27 er kun blevet observeret i hjerne- og muskelvæv, så vi antog, at et andet mere allestedsnærværende enzym skal eksistere for lysofagi i andre celletyper."
Holdet brugte polystyrenperler belagt med et reagens, der kunne inducere endosomal skade og derefter blive ubiquitineret. De isolerede derefter perlerne gennem centrifugering og brugte en metode kaldet massespektrometri til at identificere de proteiner, der er forbundet med dem, og i sidste ende indsnævrede listen til 123 proteiner.
"Ved hjælp af molekylære teknikker, hvor vi kunne slå ekspressionen af disse forskellige proteiner ned, fandt vi ud af, at proteiner kaldet CUL4A, DDB1 og WDFY1 udgør et kompleks, der reagerer på lysosomale skader," forklarer Maho Hamasaki, seniorforfatter af undersøgelsen.
Yderligere karakterisering indikerede, at dette kompleks virker fortrinsvis under lysofagi og letter tilføjelsen af ubiquitin-molekylerne. WDFY1-proteinet er nødvendigt for specifikt at genkende de beskadigede lysosomer.
"Vi spekulerede på, hvilken del af lysosomet der genkendes af dette proteinkompleks," siger Teranishi. "Mange lysosomale proteiner blev undersøgt, indtil vi fandt, at LAMP2 var den, der er ubiquitineret af CUL4A-komplekset."
Holdet fandt også, at tilstedeværelsen af LAMP2 og dens interaktion med WDFY1 er afgørende for at starte lysofagiprocessen. Samlet set giver disse resultater kritisk indsigt i de molekylære mekanismer, der er centrale for lysofagi. Dette kan også hjælpe med at bekæmpe sygdomme, hvor denne proces er dysreguleret. I fremtiden planlægger forskerne at bestemme mere præcise detaljer om, hvordan CUL4A-komplekset genkender LAMP2. + Udforsk yderligere
PITT-vej:Forskere opdager, hvordan celler reparerer et levetidsfremmende 'genbrugssystem'
 Varme artikler
Varme artikler
-
 Hvad forårsager DNA -mutation?Hvad kan bare ødelægge dette? iStockphoto.com/Henrik5000 Tænk på dit samfunds trafik. Når lysene fungerer, chauffører opfører sig (normalt). Bryde et lys, og alt går i stå. I vores kroppe, vi kunne s
Hvad forårsager DNA -mutation?Hvad kan bare ødelægge dette? iStockphoto.com/Henrik5000 Tænk på dit samfunds trafik. Når lysene fungerer, chauffører opfører sig (normalt). Bryde et lys, og alt går i stå. I vores kroppe, vi kunne s -
 Hvad er grundlaget for undtagelser fra Aufbau-princippet?Aufbau betyder opbygning på tysk, og Aufbau-princippet siger, at elektroner fylder elektronskaller omkring atomer i henhold til energiniveauet. Dette betyder, at elektronskaller og underskaller omk
Hvad er grundlaget for undtagelser fra Aufbau-princippet?Aufbau betyder opbygning på tysk, og Aufbau-princippet siger, at elektroner fylder elektronskaller omkring atomer i henhold til energiniveauet. Dette betyder, at elektronskaller og underskaller omk -
 Identifikation af en ny familie af lys-responsive proteinerTræet viser udviklingen af OCPer i cyanobakterier, begyndende med den forfædres Gloeobacter (nederst). OCP2 (grøn) forekommer tidligere, og dermed er mere primitiv, end OCP1 (gul). Fremyella, (i det
Identifikation af en ny familie af lys-responsive proteinerTræet viser udviklingen af OCPer i cyanobakterier, begyndende med den forfædres Gloeobacter (nederst). OCP2 (grøn) forekommer tidligere, og dermed er mere primitiv, end OCP1 (gul). Fremyella, (i det -
 Hvad er nogle egenskaber ved DNA?DNA eller deoxyribonucleinsyre er almindeligt kendt som den grundlæggende byggesten i livet. Disse molekyler indeholder en genetisk kode, der dikterer cellulær aktivitet og biologisk udvikling i næ
Hvad er nogle egenskaber ved DNA?DNA eller deoxyribonucleinsyre er almindeligt kendt som den grundlæggende byggesten i livet. Disse molekyler indeholder en genetisk kode, der dikterer cellulær aktivitet og biologisk udvikling i næ
- Brasilien ophæver forbuddet mod sukkerrørsopdræt i Amazon
- Kvinder i topledelsesteams øger virksomhedens miljøstrategier i vækstøkonomier
- Kabul kvæler i snavset luft, når temperaturen stiger
- Europa syder i hedebølge, da brande rammer Portugal (opdatering)
- Hvad er de primære funktioner ved fosfolipider?
- Ny metodologi hjælper med at studere lovende målrettet lægemiddelleveringsstillads


