Undersøgelse foreslår ny mekanisme til lipidtransporter
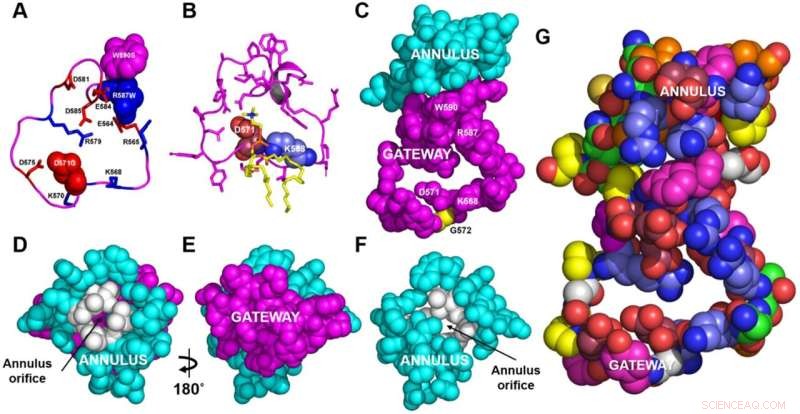
Strukturelle detaljer af gateway/ring-komplekset. A, B Rygraden i gatewayen (magenta). A De basiske (blå, stick) og sure (røde, stick) aminosyrerester af gatewayen (rest 564-592, magenta) fra ABCA1-strukturen bestemt af cryo-EM. De tre aminosyrerester i gatewayen, der vides at være muteret i Tangiers sygdom (fire punktmutationer i alt) er vist i den rumudfyldende tilstand. B POPC-molekylet (gul pind) danner saltbroer til resterne D571 og K568 (hhv. rumfyldende rød og blå) i 1,9 µs-rammen under grovkornet molekylær dynamik (CGMD)-modellering af umuteret ABCA1. Alle sidekæder undtagen rester D571 og K568 er magenta stick. C Gateway (magenta)/annulus (cyan) komplekset. Rester af den aflange hydrofobe tunnel, der ligger inden for 10 Å af enhver gateway-rest, danner annulus-domænet (rest 69, 71-80, 363 og 368-379). D Ringringen (cyan) set fra siden modsat det udadvendte transmembrane hulrum. Bemærk den lille åbning (resterne 73–75, 77, 78, 371, 375, farvet hvid) i midten af ringen, gennem hvilken magentafarvede rester af gatewayen på den modsatte side er synlige. E Basis af ringen (D) drejede 180° rundt om y-aksen for at vise gatewayen. Udsigten er fra det udadvendte transmembrane hulrum. F Repræsentation af annulus med gatewayen fjernet for at vise annulus åbningen. G Aminosyresammensætningen af gateway/annulus-komplekset. Sure rester, rose; basiske rester, blå; aromatiske rester, magenta; hydrofobe rester, orange; proliner, gule; neutrale rester, grønne; glyciner, hvid. Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-32437-3
En ny model tyder på, at et protein involveret i dannelsen af high-density lipoprotein (HDL) virker anderledes end tidligere antaget.
HDL er kendt som det "gode kolesterol", fordi det flytter fedt og kolesterol væk fra arterievæggene og kan hjælpe med at forhindre eller reducere åreforkalkning og koronar hjertesygdom.
Jere Segrest, MD, Ph.D., professor i medicin i afdelingen for kardiovaskulær medicin, og kolleger brugte computersimulering og cellekulturstudier til at udforske, hvordan proteinet ABCA1 transporterer fedtmolekyler fra cellens plasmamembran til HDL. Forskerne rapporterede i tidsskriftet Nature Communications at ABCA1 ekstraherer fosfolipider fra den ydre overflade af plasmamembranen, snarere end den indre overflade som tidligere antaget.
"Vores model af ABCA1 som en ekstracellulær lipidtransportør antyder en unik transportmekanisme, der adskiller sig væsentligt fra mekanismer beskrevet for andre medlemmer af denne transportørfamilie," sagde Segrest. "Dette overraskende fund fremhæver den bemærkelsesværdige mangfoldighed i substrattransport inden for ABCA-transportør-superfamilien.
"Denne indsigt i mekanismen for ABCA1-transport er vigtig, fordi de peger på potentielle veje til at fremme ABCA1-afhængige fosfolipid- og kolesteroludstrømning fra kolesterylesterladede makrofager, som spiller nøgleroller i alle stadier af udvikling af aterosklerotisk læsion," tilføjede Segrest.
Hyun Song, Ph.D., forskningsassistent professor i medicin, brugte grovkornede og styrede molekylære dynamiske simuleringer til at vise, at et "gateway"-domæne af ABCA1 fjerner fosfolipider fra ydersiden af membranen og passerer dem gennem en ringformet "annulus"-domæne ind i en fedtforet (hydrofob) tunnel.
Samarbejdspartnere Chongren Tang, Ph.D., og Jay Heinecke, MD, ved University of Washington, Seattle, konstruerede mutationer i gateway- og annulusdomænerne af ABCA1-transportøren og fandt ud af, at mutationerne kraftigt hæmmede lipid-eksport af ABCA1 uden at påvirke transportercellen -overfladeudtryk. + Udforsk yderligere
Statiner kan bruges til at behandle primært åbenvinklet glaukom (POAG) forbundet med lavere ABCA1-ekspression
 Varme artikler
Varme artikler
-
 Får er i stand til at genkende menneskelige ansigter fra fotografierSpørgeleder, tamfår i det lange græs. Kredit:Michael Palmer/Wikipedia Får kan trænes til at genkende menneskelige ansigter fra fotografiske portrætter - og kan endda identificere billedet af deres
Får er i stand til at genkende menneskelige ansigter fra fotografierSpørgeleder, tamfår i det lange græs. Kredit:Michael Palmer/Wikipedia Får kan trænes til at genkende menneskelige ansigter fra fotografiske portrætter - og kan endda identificere billedet af deres -
 Dejlige påskeliljer er super nemme at dyrke. Her er hvordanPåskeliljer plantet i efteråret vil blomstre i slutningen af vinteren eller det tidlige forår og kan vende tilbage år efter år og sprede sig i årtier. Loggawiggler/Pixabay Et symbol på genfødsel og
Dejlige påskeliljer er super nemme at dyrke. Her er hvordanPåskeliljer plantet i efteråret vil blomstre i slutningen af vinteren eller det tidlige forår og kan vende tilbage år efter år og sprede sig i årtier. Loggawiggler/Pixabay Et symbol på genfødsel og -
 Bryde bælgfrugter afgrøder vild relativ barriereForskere Milind (højre) og Sathyanarayana (venstre) med Sharma, registrere data om plantehøjde hos duer. Kredit:PS Rao. Indenlandse planter til at vokse som afgrøder kan vise sig at være en tveægg
Bryde bælgfrugter afgrøder vild relativ barriereForskere Milind (højre) og Sathyanarayana (venstre) med Sharma, registrere data om plantehøjde hos duer. Kredit:PS Rao. Indenlandse planter til at vokse som afgrøder kan vise sig at være en tveægg -
 Leopard fanget efter 36 timer på jagt i Indiens fabrikDen store kat blev observeret torsdag på CCTV af vagter på Maruti Suzukis fabrik i byen Manesar, kun 24 miles fra hovedstaden New Delhi En leopard på fri fod inde i Indiens største bilfabrik blev
Leopard fanget efter 36 timer på jagt i Indiens fabrikDen store kat blev observeret torsdag på CCTV af vagter på Maruti Suzukis fabrik i byen Manesar, kun 24 miles fra hovedstaden New Delhi En leopard på fri fod inde i Indiens største bilfabrik blev
- Udvider vores rækkevidde til kosmos med nye spejlbelægninger
- Fortnite lærer de forkerte lektioner
- GM tilføjer motorveje til semi-autonome køresystem
- Fald i olieefterspørgslen hjælper måske ikke på klimaemissionsmålene
- Facebook betalte brugere for at spore smartphonebrug:rapport
- Spørgsmål og svar med Kathleen Carley om spredning af desinformation om coronavirus


