Forskere finder ud af, at cellebarken aktiveres af tusindvis af kortlivede proteinkondensater
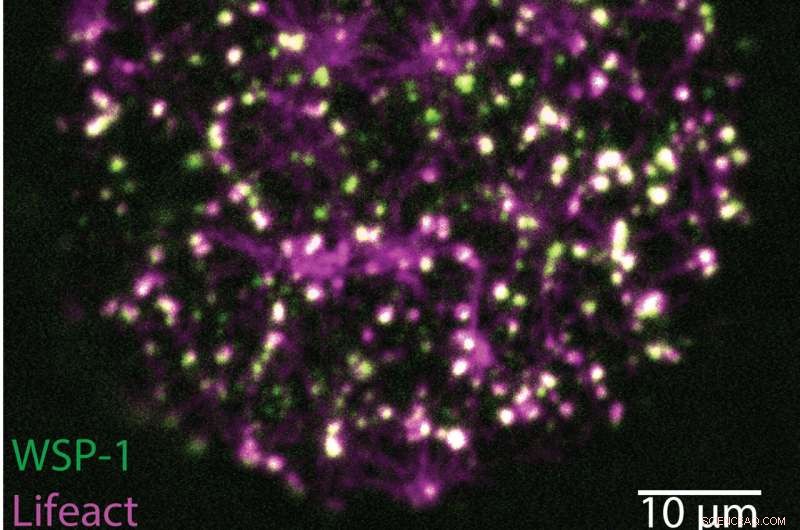
En C. elegans-oocyt er lige begyndt at danne sin cortex (øverst). F-aktin filamenter er mærket med magenta og WSP-1 med grønt. Tusindvis af små kondensater med varierende mængder af F-actin og WSP-1 dannes og falder fra hinanden på ti sekunder (nederste tidsforløb). Kredit:Nature (2022). DOI:10.1038/s41586-022-05084-3
Under udviklingen deler cellerne i et embryo sig, indtil en fuldt funktionsdygtig organisme dukker op. En komponent i cellen er særlig vigtig under denne proces:cellebarken. Dette fine netværk af hårlignende filamentstrukturer (kaldet actin) lige under cellemembranen er den vigtigste determinant for celleform og er involveret i næsten alt, hvad en celle gør, såsom at bevæge sig, dele sig eller føle sine omgivelser.
Alligevel skal cortex først bygges af enkelte molekyler, og hvis den ikke er bygget helt rigtigt, ville cellerne i en organisme aldrig komme det rigtige sted til at udføre deres funktioner. Et internationalt team af forskere fra Max Planck Institute of Molecular Cell Biology and Genetics (MPI-CBG) i Dresden, Max Planck Institute for the Physics of Complex Systems (MPI-PKS) og Cluster of Excellence Physics of Life (PoL) ) ved TU Dresden studerede dannelsen af denne dynamiske cellebark i rundormen Caenorhabditis elegans.
De fandt ud af, at tusindvis af dynamiske og kortlivede dråbelignende kondensater, der består af actinfilamenter, styrer dannelsen af en første cortex, på det tidspunkt, hvor en ubefrugtet ægcelle overgår til et embryo efter befrugtning. Principperne afdækket i denne undersøgelse hjælper med at forstå, hvordan dannelsen af subcellulære strukturer kontrolleres.
Lige efter en ægcelle er befrugtet, begynder dannelsen af cellebarken, og det tager cirka ti minutter, indtil den er færdigdannet. Cortex består af actinfilamenter og motorproteiner, som er organiseret i et tæt tværbundet netværk. Dynamikken i cortex stammer fra motorproteiner, der trækker på aktinfilamenter, hvilket genererer spændinger, der resulterer i kortikal spænding.
Denne kortikale spænding driver for eksempel cellernes form, deres evne til at fornemme deres omgivelser og deres evne til at udføre deres funktioner i vores kroppe. Cellebarkens dynamik er blevet grundigt undersøgt tidligere, men mekanismen, hvorved cellebarken først aktiveres lige efter befrugtning, er ukendt. Det er afgørende at forstå principperne bag cellebarkdannelsen, da den er involveret i næsten alle funktioner i cellen, og forkert organisering af cortex fører til en svækkelse af centrale cellulære og udviklingsmæssige processer.
Proteinkondensater har en kort levetid og sikrer en korrekt udvikling
For at undersøge, hvordan cellebarken bliver aktiveret, studerede et tværfagligt team af forskere ved MPI-CBG, MPI-PKS og PoL denne proces i rundormen C. elegans.
"Vi var i stand til at observere, hvordan aktin og de aktinkernedannende proteiner WSP-1 og ARP2/3 kom sammen for at samles til kondensater, der kun varede sekunder, bare for at skilles ad lige derefter. Disse kondensater sikrer, at der er den rigtige mængde aktinfilamenter og at de er forbundet på den helt rigtige måde. For mig ligger skønheden ved disse strukturer, lavet af stærkt forgrenede aktinfilamenter, som et snefnug, i, hvad deres dynamik lærer os om den ukonventionelle kemi af levende stof," forklarer Arjun Narayanan , en af hovedforfatterne af undersøgelsen og forsker i gruppen af Stephan Grill, direktør hos MPI-CBG.
Victoria Tianjing Yan, den anden hovedforfatter, siger, at de "udviklede vores egen billed- og billedanalysemetode, kaldet massebalancebilleddannelse, for at studere, hvordan strukturen af de kortlivede kondensat vokser og udvikler sig." Under deres undersøgelser fandt forskerne ud af, at interne kemiske reaktioner styrer, hvor hurtigt et kondensat vokser, og hvornår det skrumper væk. Kortikale kondensater organiserer således deres egen livscyklus, stort set uafhængigt af deres ydre miljø.
Grill siger, at de "konkluderer, at kondensaterne i cellebarken repræsenterer en ny type biomolekylært kondensat drevet af specifikke kemiske reaktioner for at samles og skilles ad inden for sekunder. Vi foreslår, at disse kortlivede kondensater styrer aktiveringen af cellebarken og den delikate præcision. af dens voksende arkitektur efter befrugtning af C. elegans oocytten."
Frank Jülicher, direktør hos MPI-PKS og en anden superviserende forfatter, siger, at "denne undersøgelse er endnu et eksempel på at bygge bro mellem fysik og biologi her i Dresden. Vores interaktive miljø med biologer og teoretiske fysikere sikrer sammen nye tværfaglige tilgange til at optrevle den biologiske fysik processer."
Forskningen blev offentliggjort i Nature . + Udforsk yderligere
Distinkte roller for myosiner i at 'tune' celleform til deling
Sidste artikelKønsceller bevæger sig som små bulldozere
Næste artikelUndersøgelse foreslår ny mekanisme til lipidtransporter
 Varme artikler
Varme artikler
-
 Hvor mange kongeørne er der?En ny metode gør det lettere for forskere at estimere bestandsstørrelser af svære at tælle Golden Eagles. Kredit:D. Brandes For at bevaringsindsatsen skal være effektiv, dyrelivsforvaltere skal vi
Hvor mange kongeørne er der?En ny metode gør det lettere for forskere at estimere bestandsstørrelser af svære at tælle Golden Eagles. Kredit:D. Brandes For at bevaringsindsatsen skal være effektiv, dyrelivsforvaltere skal vi -
 Når farlige toksiner lærer grundlæggende biologiGrafisk abstrakt. Kredit:Udviklingscelle (2022). DOI:10.1016/j.devcel.2022.09.004 Det, vores arbejde viser, er, hvordan et kompleks i midten af cellen, ER-Golgi-interaktionsregionen, kontrollerer
Når farlige toksiner lærer grundlæggende biologiGrafisk abstrakt. Kredit:Udviklingscelle (2022). DOI:10.1016/j.devcel.2022.09.004 Det, vores arbejde viser, er, hvordan et kompleks i midten af cellen, ER-Golgi-interaktionsregionen, kontrollerer -
 Nucleus: Definition, struktur og funktion (med diagram)Cellen er den grundlæggende organisatoriske og funktionelle komponent i levende ting, idet den er den enkleste naturlige konstruktion, der inkluderer alle de egenskaber, der er tildelt til livet. F
Nucleus: Definition, struktur og funktion (med diagram)Cellen er den grundlæggende organisatoriske og funktionelle komponent i levende ting, idet den er den enkleste naturlige konstruktion, der inkluderer alle de egenskaber, der er tildelt til livet. F -
 Sæsonbestemte billeder afslører videnskaben bag stamcellerMikrograf af et juletræ bestående af stamceller. Kredit:Catarina Moura, University of Southampton Ved første øjekast, et par prisvindende billeder skabt af University of Southampton postgraduate r
Sæsonbestemte billeder afslører videnskaben bag stamcellerMikrograf af et juletræ bestående af stamceller. Kredit:Catarina Moura, University of Southampton Ved første øjekast, et par prisvindende billeder skabt af University of Southampton postgraduate r
- En ny type robotmikroskop
- Ideer til et CO2-bilprojekt
- Ultrahurtige partikelinteraktioner kan gøre kvanteinformationsenheder mulige
- Efter et årti, League of Legends forbliver i toppen af sit spil
- Pandekageis:Isformationen, der ikke handler om morgenmad
- Carbon nanorør lover forbedret flammebestandig belægning


