Bakteriemodel hjælper med at afsløre, hvordan vores kroppe forhindrer befolkningseksplosioner - og kræft
For at størrelsen af enhver befolkning skal forblive stabil over tid, skal dens fødsels- og dødsrater afbalanceres. Hvis fødselsraten er for høj, kan der være tale om en befolkningseksplosion; hvis den er for lav, vil befolkningen skrumpe. Denne form for balance eksisterer for eksempel blandt de omkring 10.000 milliarder celler, der udgør vores krop.
Når vi bliver voksne, kan vores stamceller dele sig for at forny kropsvæv, men efter at have delt sig flere gange bliver de til modne celler, der deler sig et par gange og derefter dør. Vi bemærker kun denne ligevægt, når den er forstyrret – for eksempel når celler begynder at dele sig ukontrolleret og skaber kræftfremkaldende vækster.
Det følger heraf, at en balance mellem delende og modne celler er en forudsætning for eksistensen af enhver flercellet organisme, men hvordan opretholdes den? I en ny undersøgelse offentliggjort for nylig i Cell , brugte forskere fra Weizmann Institute of Science encellede organismer til bedre at forstå, hvordan flercellede organismer opretholder denne ligevægt og beskytter sig selv mod kræft.
Celledifferentiering er en biologisk "specialiseringsuddannelse", hvor en stamcelle deler sig i to datterceller, hvoraf den ene indtager en defineret rolle og får de egenskaber, der er nødvendige for at opfylde den. Når celler gennemgår differentiering, er deres nye speciale nyttig for den flercellede organisme, som de er en del af, men de betaler en stor individuel vejafgift:Jo længere de kommer ad denne specialiseringsvej, jo mere falder deres evne til at replikere, indtil de ikke er længere i stand til overhovedet at dele.
Denne langsomme deling af differentierede celler gør dem sårbare over for populationer af celler, der deler sig og vokser hurtigere og derfor kan overtage vævet og dets ressourcer. I nogle typer blodkræft, for eksempel, gennemgår stamceller i knoglemarven en mutation, der bremser deres differentiering og giver dem mulighed for at producere flere datterstamceller. Disse mutantceller drager fordel af det naturlige svage punkt i differentieringsprocessen og overvinder populationen af raske celler i en proces kendt som mutantovertagelse.
Selvom en mutation i gennemsnit forekommer i hver celledeling i vores kroppe, nyder de fleste af os årtiers godt helbred gennem utallige celledelinger uden at opleve mutantovertagelse. Dette tyder på, at der er effektive mekanismer til at håndtere denne trussel, selvom de er svære at identificere i komplekse organismer.
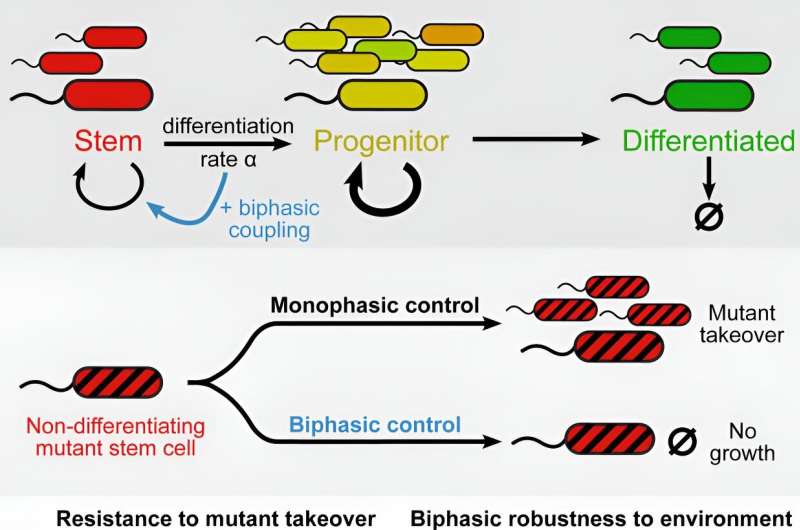
Forskere i prof. Uri Alons forskningsgruppe ved Weizmanns afdeling for molekylær cellebiologi besluttede at konstruere E. coli-bakterier, som normalt ikke differentierer, for at få dem til at gennemgå en kunstig differentieringsproces, der giver forskere mulighed for at studere, hvordan en cellepopulation håndterer mutanter overtagelse.
"Der er en række klare fordele ved E. coli-modellen," forklarer Dr. David Glass, der ledede undersøgelsen i Alons laboratorium. "En af dem er en kort generationstid, som gjorde det muligt for os at studere udviklingen af mutanter over hundreder af generationer i laboratoriet."
For at producere E. coli-bakterier, der er i stand til at differentiere, tog forskerne inspiration fra cyanobakterier kaldet Anabaena, som differentierer - ved at skære visse segmenter af deres DNA ud - som reaktion på en mangel på nitrogen i deres miljø. Selvom de differentierede bakterier mister evnen til at dele sig, får de en vigtig overlevelsesfordel:evnen til at forsyne sig selv og hele kolonien med nitrogen.
For at efterligne differentieringsprocessen i E. coli-modellen dyrkede forskerne bakterierne i et miljø, der inkluderede antibiotika, men manglede en essentiel aminosyre. Ved hjælp af genteknologi indsatte de i hver bakterie flere kopier af et gen for antibiotikaresistens og flere kopier af et gen, der producerede den manglende aminosyre.
Før processen med kunstig differentiering begyndte – det vil sige når bakterierne var i en tilstand svarende til stamcellers – var antibiotikaresistensgener aktive, så bakterierne var i stand til at dele sig og differentiere sig i høj hastighed på trods af tilstedeværelsen af antibiotika.
Da differentieringsprocessen startede ved at skære antibiotikaresistensgenerne ud, mistede bakterierne gradvist deres evne til at dele sig og differentiere, men de fik en overlevelsesfordel:Skæringerne i DNA'et aktiverede gradvist de gener, der producerede den essentielle aminosyre.
"For at bestemme, hvilken differentieringshastighed der virker bedst, afholdt vi en konkurrence mellem 11 stammer af E. coli, som hver skærer DNA-segmenter ud - det vil sige differentierer - i en anden hastighed," forklarer Glass. "Vi blandede lige store mængder af bakterierne, dyrkede dem i løbet af et par dage og tjekkede derefter for at se, hvilke der havde overlevet.
"Vi opdagede en meget stærk selektion til fordel for bakterier, der differentierede med en moderat hastighed, og fandt ud af, at bakteriestammer med en moderat differentieringshastighed opretholdt den optimale balance af celletyper i deres population. På ethvert givet tidspunkt var kun et mindretal af de celler var 'rene stamceller' eller 'fuldt differentierede celler', og størstedelen blev fundet i mellemliggende tilstande af processen."
Denne optimale, moderate differentieringshastighed deles af forskellige systemer i den menneskelige krop, hvor der opretholdes en kvantitativ balance mellem stamceller, progenitorceller på forskellige stadier af differentiering og differentierede celler, der lejlighedsvis dør og erstattes af nye.
For at holde bestandsstørrelsen stabil er det vigtigt at opretholde denne ligevægt, selv når miljøforholdene ændrer sig. For at finde ud af, om bakterierne i deres model faktisk opretholdt denne ligevægt selv under ændrede forhold, dyrkede forskerne dem i 36 forskellige kombinationer af antibiotika- og aminosyrekoncentrationer i dyrkningsmediet.
"Vi så, at i enhver situation - bortset fra de mest ekstreme, såsom et totalt fravær af antibiotika - forblev cellernes optimale differentieringshastighed i det moderate område, og ligevægten blev opretholdt," forklarer Glass. "Det betyder, at den befolkningsligevægt, der karakteriserer den differentieringsmodel, vi udviklede, i vid udstrækning er immun over for miljøændringer og trusler."
Men er en population af bakterier, der differentierer sig med en optimal hastighed, også immun over for mutantovertagelse, ligesom systemerne i flercellede organismer?
For at teste disse bakteriers evne til at modstå mutantovertagelse, dyrkede forskerne dem over mange generationer og kontrollerede, om der opstod tilfældige mutationer i den lange vækstperiode, hvilket skaber bakterier, der slet ikke differentierer sig og deler sig ukontrolleret. Med andre ord, bevirker mutante bakterier mutantovertagelse, eller undertrykkes de på et tidligt tidspunkt?
Første gang de gennemførte eksperimentet, var forskerne skuffede over at finde mutantovertagelser i halvdelen af tilfældene. "Vi fandt ud af, at når en genetisk ændring bryder forbindelsen mellem nedsættelse af differentiering og opnåelse af den overlevelsesfordel, kan mutanter, der ikke differentierer sig, tage over," tilføjer Glass.
Dernæst gentog forskerne eksperimentet med en ny bakteriestamme, der var gensplejset til at være immun over for den identificerede mutation. "Vi formåede at dyrke omkring 270 generationer af differentierende bakterier, og der fandt ingen mutantovertagelse sted. Desværre afbrød invasionen af Israel den 7. oktober eksperimentet, og bakterierne kan meget vel være endnu mere modstandsdygtige," siger Glass.
"Vi viste, at et system, hvor differentierende E. coli-celler holder op med at dele sig, men opnår en overlevelsesfordel, kan opretholde en optimal befolkningsbalance og afværge mutantovertagelse. Mange sygdomme, såsom cancer og autoimmune lidelser, er unikke for flercellede organismer. Når vi genetisk set udvikler flere og flere karakteristika ved flercellede systemer i encellede organismer, kan vi afdække svage punkter og også lede efter dem i menneskeligt væv."
"Ud over grundlæggende videnskab kan disse nye resultater også have en indvirkning på brugen af bakterier i industrien," tilføjer Glass. "Genmanipulerede bakterier bruges i øjeblikket i storskalaproduktion af insulin, enzymer og andre stoffer, der bruges af mennesker. At skabe en population af differentierende bakterier, der bevarer sin ligevægt, fornyer sig selv og endda forhindrer mutantovertagelse, kunne være meget nyttig i disse produktionsprocesser. ."
Flere oplysninger: David S. Glass et al., Et syntetisk differentieringskredsløb i Escherichia coli til undertrykkelse af mutantovertagelse, celle (2024). DOI:10.1016/j.cell.2024.01.024
Journaloplysninger: Celle
Leveret af Weizmann Institute of Science
 Varme artikler
Varme artikler
-
 Ny software kan bekræfte en persons identitet ved deres DNA på få minutterFor at demonstrere teknologiens bærbarhed, forskere pakket MinION og alle nødvendige celleforberedelsesmaterialer ned i en håndtaske. Kredit:Sophie Zaaijer I science fiction-filmen Gattaca, besøge
Ny software kan bekræfte en persons identitet ved deres DNA på få minutterFor at demonstrere teknologiens bærbarhed, forskere pakket MinION og alle nødvendige celleforberedelsesmaterialer ned i en håndtaske. Kredit:Sophie Zaaijer I science fiction-filmen Gattaca, besøge -
 Kviksølvforurening gør ænder mere tilbøjelige til at få fugleinfluenza:undersøgelseÆnder menes at være superspredere af fugleinfluenza, delvis fordi de rejser så langt, som de trækker. Ænder, der er forurenet med kviksølvforurening, er betydeligt mere tilbøjelige til at få fuglei
Kviksølvforurening gør ænder mere tilbøjelige til at få fugleinfluenza:undersøgelseÆnder menes at være superspredere af fugleinfluenza, delvis fordi de rejser så langt, som de trækker. Ænder, der er forurenet med kviksølvforurening, er betydeligt mere tilbøjelige til at få fuglei -
 Lake Michigan vandfugle botulisme dødsfald forbundet med varmt vand, algerKort, der viser de tre regioner i øvre Lake Michigan, der er undersøgt i den aktuelle undersøgelse. Citizen Scientists gik regelmæssigt langs strandene i disse regioner for at undersøge for syge og dø
Lake Michigan vandfugle botulisme dødsfald forbundet med varmt vand, algerKort, der viser de tre regioner i øvre Lake Michigan, der er undersøgt i den aktuelle undersøgelse. Citizen Scientists gik regelmæssigt langs strandene i disse regioner for at undersøge for syge og dø -
 Hvordan boaer redder sig selv fra at blive kvalt, når de snerper og fordøjer aftensmadKredit:Pixabay/CC0 Public Domain De senere stadier af graviditeten kan gøre livet svært, da fosteret presser mod mellemgulvet, hvilket gør det svært at trække vejret. Men slanger, der trækker deres
Hvordan boaer redder sig selv fra at blive kvalt, når de snerper og fordøjer aftensmadKredit:Pixabay/CC0 Public Domain De senere stadier af graviditeten kan gøre livet svært, da fosteret presser mod mellemgulvet, hvilket gør det svært at trække vejret. Men slanger, der trækker deres
- Bør vi være bekymrede over stigende hede i den politiske diskurs? Ja, siger eksperter
- Akustiske bølger giver et skub til seismisk billeddannelse i realtid
- Hvordan fysik og biologi arbejder sammen for at udforske livets mekanismer
- Gå ikke i panik:Erfaringer fra Hawaii falsk alarm
- En tidskapsel indeholdende 118 billioner kubikfod gas er begravet i det nordlige Australien
- Nanostrukturerede metalbelægninger slipper lyset igennem til elektroniske enheder


