Ny undersøgelse opdager et lille mål på RNA for at kortslutte betændelse
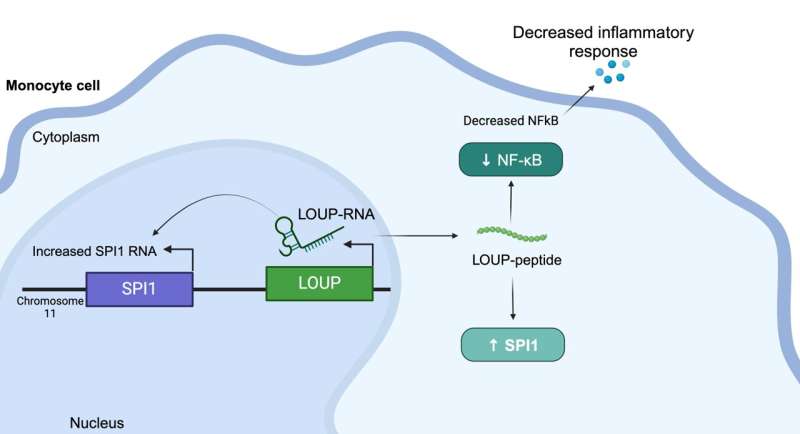
UC Santa Cruz forskere har opdaget et peptid i humant RNA, der regulerer inflammation og kan give en ny vej til behandling af sygdomme som gigt og lupus. Holdet brugte en screeningsproces baseret på det kraftfulde genredigeringsværktøj CRISPR til at kaste lys over et af de største mysterier om vores RNA – molekylet, der er ansvarligt for at udføre genetisk information indeholdt i vores DNA.
Dette peptid stammer fra et langt ikke-kodende RNA (lncRNA) kaldet LOUP. Ifølge forskerne koder det menneskelige genom for over 20.000 lncRNA'er, hvilket gør det til den største gruppe af gener, der produceres fra genomet. Men på trods af denne overflod ved forskerne kun lidt om, hvorfor lncRNA'er eksisterer, eller hvad de gør. Dette er grunden til, at lncRNA nogle gange omtales som "genomets mørke stof."
Undersøgelsen blev offentliggjort den 23. maj i Proceedings of the National Academy of Sciences (PNAS), er en af de meget få i den eksisterende litteratur, der afskærer mysterierne bag lncRNA. Det præsenterer også en ny strategi til at udføre high-throughput screening for hurtigt at identificere funktionelle lncRNA'er i immunceller. Pooled-screen-tilgangen giver forskere mulighed for at målrette tusindvis af gener i et enkelt eksperiment, hvilket er en meget mere effektiv måde at studere ukarakteriserede dele af genomet på end traditionelle eksperimenter, der fokuserer på ét gen ad gangen.
Forskningen blev ledet af immunolog Susan Carpenter, en professor og Sinsheimer-formand for UC Santa Cruz's afdeling for molekylær-, celle- og udviklingsbiologi. Hun studerer de molekylære mekanismer, der er involveret i beskyttelse mod infektion. Specifikt fokuserer hun på de processer, der fører til inflammation, for at bestemme den rolle, som lncRNA'er spiller i disse veje.
"Inflammation er et centralt træk ved næsten enhver sygdom," sagde hun. "I denne undersøgelse fokuserede mit laboratorium på at forsøge at bestemme, hvilke lncRNA-gener der er involveret i at regulere inflammation."
Dette betød at studere lncRNA'er i en type hvide blodlegemer kendt som en monocyt. De brugte en modifikation af CRISPR/Cas9-teknologien, kaldet CRISPR-hæmning (CRISPRi), til at undertrykke gentransskription og finde ud af, hvilke af en monocyts lncRNA'er, der spiller en rolle i, om den differentierer til en makrofag - en anden type hvide blodlegemer, der er afgørende for et velfungerende immunrespons.
Derudover brugte forskerne CRISPRi til at screene makrofag-lncRNA for involvering i inflammation. Uventet fandt de en region, der er multifunktionel og kan fungere som et RNA samt indeholde et uopdaget peptid, der regulerer inflammation.
At forstå, at dette specifikke peptid regulerer inflammation, giver lægemiddelproducenter et mål for at blokere den molekylære interaktion bag dette svar for at undertrykke det, sagde Carpenter. "I en ideel verden ville du designe et lille molekyle for at forstyrre den specifikke interaktion, i stedet for for eksempel at målrette mod et protein, der kunne udtrykkes i hele kroppen," forklarede hun. "Vi er stadig langt fra at målrette disse veje med det niveau af præcision, men det er bestemt målet. Der er stor interesse for RNA-terapi lige nu."
Medforfattere til undersøgelsen fra UC Santa Cruz omfatter Haley Halasz, Eric Malekos, Sergio Covarrubias, Samira Yitiz, Christy Montano, Lisa Sudek og Sol Katzman sammen med forskere ved UCSF og MIT.
Flere oplysninger: Haley Halasz et al., CRISPRi-skærme identificerer lncRNA, LOUP, som et multifunktionelt locus, der regulerer makrofagdifferentiering og inflammatorisk signalering, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2322524121
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af University of California - Santa Cruz
 Varme artikler
Varme artikler
-
 Gør planter musik?Plantenes indre liv er sandsynligvis meget rigere og mere kompliceret, end vi tror, men skaber de egentlig musik? George Rose/Getty Images Hvis du befinder dig i Torino, Italien, du vil måske tage en
Gør planter musik?Plantenes indre liv er sandsynligvis meget rigere og mere kompliceret, end vi tror, men skaber de egentlig musik? George Rose/Getty Images Hvis du befinder dig i Torino, Italien, du vil måske tage en -
 Ørevoks som iskerner - låser op for fortiden skjult i hvalørepropperPukkelhvaler som disse har en varierende kost, som kan registreres i stabile kulstofisotoper lagdelt ind i ørevokspropperne, der er opbygget i løbet af deres liv. Kredit:Vicky Stein Farzaneh Manso
Ørevoks som iskerner - låser op for fortiden skjult i hvalørepropperPukkelhvaler som disse har en varierende kost, som kan registreres i stabile kulstofisotoper lagdelt ind i ørevokspropperne, der er opbygget i løbet af deres liv. Kredit:Vicky Stein Farzaneh Manso -
 Dyrs mitokondrierforsvar opdaget i planterArabidopsis thaliana planter brugt i denne undersøgelse. Til venstre er en plante under normale vækstforhold, mens til højre er en plante behandlet med doxycyclin, som har hæmmet væksten markant, men
Dyrs mitokondrierforsvar opdaget i planterArabidopsis thaliana planter brugt i denne undersøgelse. Til venstre er en plante under normale vækstforhold, mens til højre er en plante behandlet med doxycyclin, som har hæmmet væksten markant, men -
 Frankrig vil modsætte sig EU's 5-årige fornyelse af ukrudtsmiddel glyphosatAktivister har opfordret til at forbyde glyphosat Frankrig vil modsætte sig et forslag fra Europa-Kommissionen om at forlænge godkendelsen af det kontroversielle ukrudtsbekæmpende glyphosat i fe
Frankrig vil modsætte sig EU's 5-årige fornyelse af ukrudtsmiddel glyphosatAktivister har opfordret til at forbyde glyphosat Frankrig vil modsætte sig et forslag fra Europa-Kommissionen om at forlænge godkendelsen af det kontroversielle ukrudtsbekæmpende glyphosat i fe
- Grafenoxidmembraner kan reducere papirindustriens energiomkostninger
- Tre variable, der kan påvirke aktiviteter af et enzym
- Hvor meget påvirker Airbnb egentlig huslejer og boligpriser?
- Nuldimensionel transistor høster bobleenergi spildt under vandelektrolyse
- Fiskebioaffald omdannet til piezoelektriske energioptagere
- Milepæl for næste generation af solid-state batterier til at drive fremtidige langdistance elektri…


