Genanvendt protease styrer vigtigt signalmolekyleaktiverende protein

Effektiv kommunikation mellem celler er afgørende for mange biologiske processer, såsom rekruttering af immunceller til at bekæmpe sygdom. Den hurtige frigivelse af mindst 80 signalmolekyler, inklusive tumornekrosefaktor og epidermal vækstfaktor, styres af en membranbundet protease kaldet ADAM17.
Denne proces involverer ADAM17, der spalter (udskiller) signalmolekylerne fra deres precursorformer i membranen af en celle. "Pseudoproteasen" iRhom2 hjælper med modningen og transporten af ADAM17. En mangel på strukturel indsigt har imidlertid efterladt mekanismerne bag denne proces uklare.
Udgivet i dag i Molecular Cell , har forskere fra St. Jude Children's Research Hospital og University of Oxford brugt kryo-elektronmikroskopi til at afsløre en række strukturer af det menneskelige ADAM17/iRhom2-kompleks i både den aktive og inaktive tilstand. Disse strukturer viser, at iRhom2 fungerer som en gatekeeper til ADAM17's livscyklus og interagerer med nøgleområder i ADAM17, der styrer dens aktivitet.
Arbejdet tilbyder også potentielle muligheder for lægemiddeldesign til at bekæmpe sygdomme med kronisk inflammation og autoimmun dysregulering. "Vi mener, at der er potentiale for at designe små molekyler, der målretter mod iRhom2 i stedet for ADAM17 direkte, eller grænsefladen mellem iRhom2 og ADAM17," sagde medkorrespondent forfatter, Chia-Hsueh Lee, Ph.D., St. Jude Department of Strukturel Biologi .
Nedlagt protease finder et nyt liv
iRhom2 er en pseudoprotease:Den har alle de strukturelle egenskaber af en protease fra rhomboid-familien, bortset fra at den mangler den protease-definerende evne til at spalte proteiner. Men ligesom en gammel hund, der lærer nye tricks, spiller iRhom2 nyfundne roller i stilladset og transporten af ADAM17.
Som strukturelle undersøgelser afslørede, starter iRhom2's indvirkning på ADAM17-funktionen under den indledende syntese af de to proteiner. "Det endoplasmatiske retikulum er, hvor ADAM17 og iRhom2 er lavet, og på dette stadium danner de et kompleks," forklarede Lee. iRhom2 letter derefter shuttling af ADAM17 til Golgi-apparatet til modning, hvor det tidligere koncept med iRhom2, der kun tjener som et "passivt stillads", blev sat på prøve af Lees strukturer.
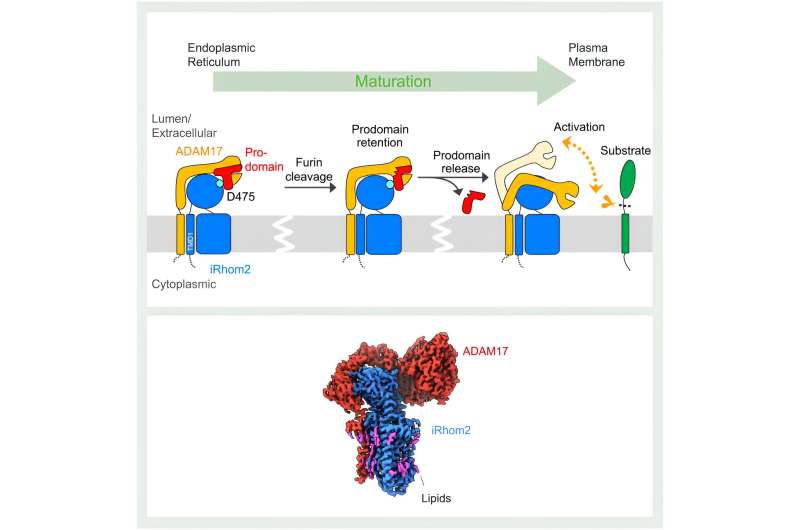
Interaktionen mellem iRhom2 og ADAM17 blev formodet udelukkende at forekomme mellem proteinernes transmembrane domæner, som fastgør proteinerne til cellemembranen. Til forskernes overraskelse interagerer de to proteiner også gennem deres ekstracellulære regioner. Gennem disse interaktioner holder iRhom2 fast i en vigtig region af ADAM17 kaldet prodomænet. Prodomænet er en region, der fungerer som en sikkerhedsnål på en ildslukker.
"ADAM17 i sig selv er selvhæmmet. Den har en prodomænehætte til at blokere sit eget proteasested," forklarede Lee.
iRhom2 hjælper med at sætte hætten på ADAM17-aktivitet
Inden for Golgi-apparatet er denne selvregulerende prodomæne-hætte kløvet. Imidlertid beholder iRhom2 ADAM17-hætten, indtil komplekset når cellemembranen. Dette trin er afgørende for at forhindre for tidlig aktivering af ADAM17. De nye strukturer afslører, at når hætten er fjernet, aktiveres ADAM17. Denne aktivering er præget af en betydelig gevinst i fleksibilitet, som gør det muligt for ADAM17 at søge i dets omgivende rum efter substrater.
ADAM17 har vist sig at spille en rolle i udviklingen og progressionen af flere cancertyper; ADAM-familien af proteiner er imidlertid godt konserveret. Et lægemiddel, der er rettet mod ADAM17, kan føre til effekter uden for målet. Lee er optimistisk over, at strukturerne kan tilbyde en plan for opfindsomhed i lægemiddeldesign.
"Baseret på vores model, hvis vi kunne holde disse to proteiner sammen, for eksempel gennem et bindemiddel, der forbedrer interaktionen mellem iRhom2 og ADAM17, så vil iRhom2 ikke frigive prodomænehætten," sagde Lee. "Dette vil reducere ADAM17-aktiviteten betydeligt."
Studiets første forfattere er Fangfang Lu, University of Oxford og Hongtu Zhao, St. Jude. Undersøgelsens andre medkorresponderende forfattere er Hongtu Zhao, St. Jude og Matthew Freeman, University of Oxford. Undersøgelsens yderligere forfattere er Yaxin Dai og Yingdi Wang, St. Jude.
Flere oplysninger: Fangfang Lu et al, Cryo-EM afslører, at iRhom2 begrænser ADAM17-proteaseaktivitet for at kontrollere frigivelsen af vækstfaktor og inflammatoriske signaler, Molecular Cell (2024). DOI:10.1016/j.molcel.2024.04.025
Journaloplysninger: Molekylær celle
Leveret af St. Jude Children's Research Hospital
 Varme artikler
Varme artikler
-
 Hvor fermenteres fiber i grisenes fordøjelseskanal?Tamgris. Kredit:Scott Bauer, USDA Fiber tilsættes i stigende grad til svinefoder, men fordøjelsen af fibre i grise er ineffektiv og dårligt forstået. I en ny undersøgelse fra University of Illin
Hvor fermenteres fiber i grisenes fordøjelseskanal?Tamgris. Kredit:Scott Bauer, USDA Fiber tilsættes i stigende grad til svinefoder, men fordøjelsen af fibre i grise er ineffektiv og dårligt forstået. I en ny undersøgelse fra University of Illin -
 Nationsskabende eller naturødelæggende? Hvorfor dets tid NZ stod over for miljøskaden fra sin kol…Kredit:National Library of New Zealand, CC BY-NC-ND Måden, hvorpå New Zealand husker europæisk kolonisering, har ændret sig markant i de senere år. Kritikere har skåret væk på det offentlige billed
Nationsskabende eller naturødelæggende? Hvorfor dets tid NZ stod over for miljøskaden fra sin kol…Kredit:National Library of New Zealand, CC BY-NC-ND Måden, hvorpå New Zealand husker europæisk kolonisering, har ændret sig markant i de senere år. Kritikere har skåret væk på det offentlige billed -
 Indavl med neandertalere gav mennesker beskyttelse mod menneskerKraniet af en neandertaler fundet i La Quina, et mellem og tidligt øvre palæolitisk sted i Gardes-le-Pontaroux, Charente, Frankrig. Wikimedia Commons (CC BY-SA 4.0) Det er muligt, at du et eller ande
Indavl med neandertalere gav mennesker beskyttelse mod menneskerKraniet af en neandertaler fundet i La Quina, et mellem og tidligt øvre palæolitisk sted i Gardes-le-Pontaroux, Charente, Frankrig. Wikimedia Commons (CC BY-SA 4.0) Det er muligt, at du et eller ande -
 Udgivet havskildpadde fører oceanografer aske ud på havetSørgende afspejles, når en havskildpadde ved navn Picasso bærer asken fra Tony Amos, 80, en kendt oceanograf, på ryggen, da den frigives tilbage i Den Mexicanske Golf efter en mindehøjtidelighed, Lørd
Udgivet havskildpadde fører oceanografer aske ud på havetSørgende afspejles, når en havskildpadde ved navn Picasso bærer asken fra Tony Amos, 80, en kendt oceanograf, på ryggen, da den frigives tilbage i Den Mexicanske Golf efter en mindehøjtidelighed, Lørd
- Dobbelt støvringtest kunne spotte migrerende planeter
- Forskere antyder, at stramme oliepriser kan være baseret på futureskontrakter i stedet for dag-til…
- Kunne vi opdage en gammel industriel civilisation i den geologiske optegnelse?
- Undersøgelse afslører høj forholdskvalitet i par af samme køn
- Hvis det tager en vandretur, ryttere vil ikke gå til cykeldeling
- Zaï-teknikken:Hvordan landmænd i Sahel dyrker afgrøder med lidt eller intet vand


