Forskere forbinder oocytspecifik histon H1FOO til bedre generering af iPS-celler
Et fælles forskerhold ledet af Dr. Akira Kunitomi, en tidligere postdoc-stipendiat ved CiRA (i øjeblikket forsker ved Gladstone Institute of Cardiovascular Disease) og ID Pharma Co., Ltd., har afsløret den afgørende rolle af oocyt-specifik linker histon , H1FOO, til at forbedre omprogrammeringseffektiviteten og homogeniteten til primede og naive pluripotente tilstande. Undersøgelsen er publiceret i Stem Cell Reports .
Mens konventionel omprogrammering producerer humane inducerede pluripotente stamceller (iPS) med "primede" karakteristika, der ligner post-implantations epiblaster med begrænset potentiale til at blive til ekstraembryonale væv, viser den "naive" pluripotente tilstand egenskaber, der mere ligner præimplantations epiblastceller og muse iPS celler , hvilket giver dem mulighed for at differentiere sig til både embryonale og ekstraembryonale slægter.
Selvom primede og naive humane iPS-celler har muliggjort biomedicinske fremskridt, der tidligere var utænkelige, er en hovedudfordring vedrørende iPS-celler til grundforskning og medicinske formål deres heterogenitet. Traditionelle omprogrammeringsmetoder forbliver en stokastisk proces, og derfor fortsætter mange forskere med at søge mere effektive og præcise midler til at generere homogene iPS-celler.
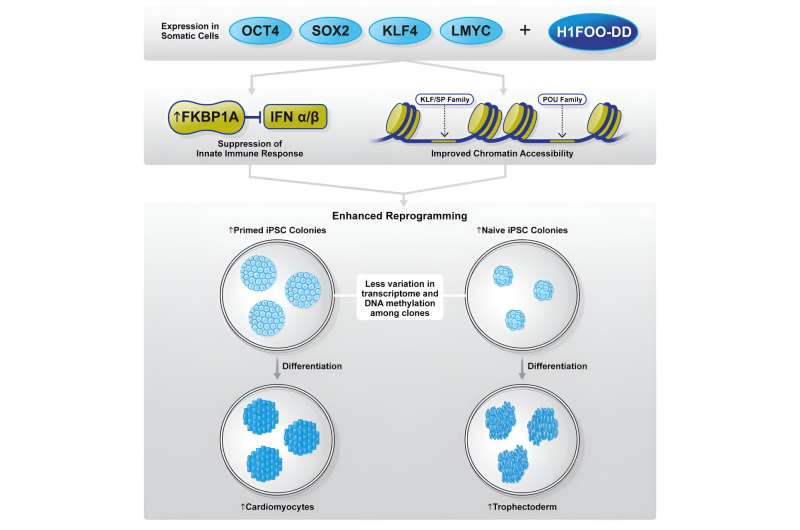
I deres nylige undersøgelse undersøgte det kollaborative forskerhold potentialet af den moderspecifikke linkerhiston H1FOO som en kandidatfaktor til at forfine omprogrammeringsprocessen. Forskerne konstruerede H1FOO ved at knytte et destabiliseringsdomæne (DD), så de kunne manipulere dets nedbrydning kemisk og omhyggeligt regulere dets niveauer.
Når de blev brugt i kombination med Yamanaka-faktorerne (OSKL, MYC blev erstattet af LMYC for at undgå tumordannelse), fandt de, at H1FOO-DD forbedrede iPS-cellegenereringseffektiviteten betydeligt, uanset hvilket genleveringssystem, der blev brugt.
Selvom genekspression og epigenetiske analyser ikke identificerede nogen meningsfulde forskelle mellem omprogrammering ved kun at bruge OSKL eller i kombination med H1FOO-DD, afslørede de dog, at ved at bruge H1FOO-DD viste de uafhængigt genererede iPS-celler et mere ens genekspressionsmønster , hvilket indikerer forbedringer af homogenitet og reproducerbarhed.
Navnlig antydede en analyse af gener med meget variabel ekspression mellem uafhængige iPS-cellelinjer, at H1FOO reducerede en sådan variabilitet med næsten halvdelen. Det er afgørende, at mange af disse gener er involveret i genekspressionsregulering, hvilket viser H1FOO-DD's evne til at vejlede omprogrammeringsprocessen mere stringent.
Desuden observerede forskerne også, at iPS-celler genereret via omprogrammering med H1FOO-DD var bedre til at differentiere til endoderm, et af tre primære kimlag, og cardiomyocytter (en mesodermal celletype).
Forskerholdet fortsatte deres undersøgelse ved at undersøge de underliggende mekanismer, hvorigennem H1FOO-DD forbedrer omprogrammering. Ved enkeltcellet RNA-sekventering (scRNA-seq)-analyse fandt forskerne, at omprogrammering med H1FOO-DD ikke kun førte til tidligere og højere ekspression af pluripotens-relaterede gener, men også undertrykte ekspressionen af gener relateret til medfødt immunrespons, inflammation og apoptose (programmeret celledød).
Især H1FOO-DD øgede andelen af celler, der blev kategoriseret som succesfuldt omprogrammerede, mens de reducerede cellesubpopulationer, der anses for at have gennemgået ufuldstændig eller mislykket omprogrammering.
I betragtning af H1FOO's rolle som en kromatin-ombygningsfaktor undersøgte forskerne også tilgængeligheden til kromatinregioner. I overensstemmelse med resultaterne fra genekspressionsanalyse åbnede kromatinregioner, især de nærliggende pluripotensmarkører, tidligere og var mere tilgængelige, når H1FOO-DD blev inkluderet som en omprogrammeringsfaktor.
Yderligere analyse viste, at POU- og KLF/SP-transskriptionsfaktorfamilier blev aktiveret tidligere under omprogrammeringsprocessen af H1FOO-DD. Disse resultater tyder på, at H1FOO-DD hjælper med at koordinere omprogrammering mere effektivt og rettidigt for at forbedre generering af iPS-celler.
Forskerne fokuserede derefter på downstream-effektorer, der hjælper med at mediere de positive virkninger af H1FOO-DD på iPS-cellegenerering ved at undersøge gener med differentiel ekspression tidligt under omprogrammering. Gennem denne analyse identificerede de 19 opregulerede og to nedregulerede gener, når H1FOO-DD blev inkluderet som en omprogrammeringsfaktor.
Forskerholdet undersøgte disse gener individuelt for at bestemme, om de påvirker primet og naiv omprogrammering og fandt ud af, at FKBP1A eller APOE overekspression forbedrer omprogrammering. Da APOE tidligere blev rapporteret som stærkt udtrykt under omprogrammering, fokuserede forskerne deres opmærksomhed på FKBP1A i håb om at afsløre nye molekylære mekanismer, der ligger til grund for vellykket omprogrammering.
De fandt især ud af, at selvom omprogrammering ved hjælp af OSKL alene øger FKBP1A-ekspressionen, øger inklusion af H1FOO-DD det dramatisk. Denne iagttagelse blev yderligere understøttet ved at genundersøge de genekspressions- og kromatintilgængelighedsdata, de allerede havde indsamlet.
FKBP1A er et immunofilin involveret i immunsuppression, der kan interagere med og hæmme TGFBR1, hvilket igen fremmer mesenkymal-til-epitelial overgang (MET) og forbedrer omprogrammeringseffektiviteten.
Forskerne antog således, at både FKBP1A-funktioner i at undertrykke medfødt immunitet og hæmme TGFBR1-medieret MET) sandsynligvis er ansvarlige for forbedringen af omprogrammeringseffektiviteten af H1FOO-DD.
De fandt især ud af, at omprogrammering via en kombination af OSKL- og FKBP1A-overekspression førte til sammenlignelig TGFBR1-undertrykkelse, MET-forstærkning, medfødt immunresponsundertrykkelse og apoptose, som da H1FOO-DD blev brugt til at starte omprogrammering.
Til sidst, fordi tidligere genekspressionsanalyse indikerede, at ud over at forbedre primet omprogrammering, H1FOO-DD også inducerede ekspressionen af naive tilstandsmarkører, undersøgte forskerne, om H1FOO-DD også er i stand til at fremme omprogrammering til den naive tilstand. Faktisk observerede de, at inklusion af H1FOO-DD væsentligt forbedrede naiv iPS-cellegenerering.
Desuden, analogt med primet omprogrammering, forstærkede H1FOO-DD omprogrammeringsprocessen ved at koordinere mere ensartet gen- og epigenetisk regulering i cellerne. Funktionelt, målt ved metabolisk aktivitet og X-kromosom-reaktivering, producerede omprogrammering ved hjælp af H1FOO-DD naive iPS-celler, der lignede mere naive embryonale stamceller eller præimplantationsblastocyster, end når OSKL blev brugt alene.
Sammenfattende identificerede kombineret indsats fra det fælles forskerhold H1FOO-FKBP1A-aksen som et middel til at omprogrammere celler med større effektivitet og præcision. Disse resultater vil vise sig at have en enorm indvirkning på generering af iPS-celler til både grundlæggende videnskabelig forskning og kliniske anvendelser.
Flere oplysninger: Akira Kunitomi et al., H1FOO-DD fremmer effektivitet og ensartethed i omprogrammering til naiv pluripotens, Stam Cell Reports (2024). DOI:10.1016/j.stemcr.2024.04.005
Journaloplysninger: Stamcellerapporter
Leveret af Kyoto University
 Varme artikler
Varme artikler
-
 Delfinsundhedstjek viser vores haves tilstandKredit:CC0 Public Domain Indtil nu har det været vanskeligt at teste delfinpopulationers helbred på grund af deres vandrende mønster, deres størrelse og i nogle tilfælde faldende antal. Forskere f
Delfinsundhedstjek viser vores haves tilstandKredit:CC0 Public Domain Indtil nu har det været vanskeligt at teste delfinpopulationers helbred på grund af deres vandrende mønster, deres størrelse og i nogle tilfælde faldende antal. Forskere f -
 På Mexicos caribiske kyst vokser bjerge af tangArbejdere, der blev ansat af beboere, fjerner sargassum-tang fra Soliman-bugten, nord for Tulum, Quintana Roo-staten, Mexico, onsdag den 3. august 2022. Kredit:AP Photo/Eduardo Verdugo At skrabe de
På Mexicos caribiske kyst vokser bjerge af tangArbejdere, der blev ansat af beboere, fjerner sargassum-tang fra Soliman-bugten, nord for Tulum, Quintana Roo-staten, Mexico, onsdag den 3. august 2022. Kredit:AP Photo/Eduardo Verdugo At skrabe de -
 Forskere opdagede overdreven social interaktion reduceret kollektiv responsSimulering af et rovdyrangreb og sværmens inducerede kollektive undvigende handling. Medlemmerne af sværmen (blå pile) kan kun opdage rovdyret (fast hvid pil), når de er inde i den røde cirkel. Men, t
Forskere opdagede overdreven social interaktion reduceret kollektiv responsSimulering af et rovdyrangreb og sværmens inducerede kollektive undvigende handling. Medlemmerne af sværmen (blå pile) kan kun opdage rovdyret (fast hvid pil), når de er inde i den røde cirkel. Men, t -
 Tarmbakterie forårsager indirekte symptomer ved at ændre frugtflues mikrobiomEn frugtfluetarm. Kredit:Tiffani Jones CagA, et protein produceret af bakterien Helicobacter pylori , kan ændre populationen af mikrober, der lever i frugtfluens tarm, fører til sygdomssymptom
Tarmbakterie forårsager indirekte symptomer ved at ændre frugtflues mikrobiomEn frugtfluetarm. Kredit:Tiffani Jones CagA, et protein produceret af bakterien Helicobacter pylori , kan ændre populationen af mikrober, der lever i frugtfluens tarm, fører til sygdomssymptom
- Ekspert advarer om klimaændringer, der forværrer jordforringelse
- Indien beder Cambridge Analytica om oplysninger om data
- Hvad er farerne ved Bobcats for mennesker?
- Polyoxometalater viser lovende som lægemiddeltransportere ind i cellen
- Nyt politisk design er nødvendigt for at tackle den globale miljøtrussel, ifølge rapport
- Sådan finder du gitterkonstant


