Forskere afslører, hvordan SID-1 genkender dsRNA og initierer systemisk RNA-interferens
RNA-interferens (RNAi) er en fascinerende biologisk proces i orme, planter, svampe og metazoer, som har været et værdifuldt værktøj til at studere genfunktion og som terapeutiske midler.
I Caenorhabditis elegans spiller multipass-transmembranproteinet, systemisk RNA-interferensdefekt protein 1 (SID-1), en uundværlig rolle i optagelsen og leveringen af dobbeltstrenget RNA (dsRNA) mellem celler og væv, hvilket fører til systemisk RNAi.
Derudover er to humane SID-1-homologer, SID1-transmembranfamiliemedlem 1 (SIDT1) og SIDT2, blevet impliceret i RNA-transport. De underliggende molekylære mekanismer for, hvordan SID-1 specifikt adskiller dsRNA fra enkeltstrenget RNA (ssRNA) og DNA og letter efterfølgende dsRNA-transport mellem celler, forbliver dog ukendte.
Svar på disse spørgsmål er vigtige for at forstå systemisk RNAi og for at hjælpe med RNA-relaterede applikationer.
Dr. Zhang Jiangtao i Prof. Jiang Daohuas gruppe fra Institut for Fysik ved Det Kinesiske Videnskabsakademi har demonstreret, hvordan SID-1 specifikt genkender dsRNA og givet vigtig indsigt i internaliseringen af dsRNA ved SID-1 ved at kombinere cryo-EM, in vitro og in vivo eksperimenter. Værket er publiceret i tidsskriftet Nature Structural &Molecular Biology .
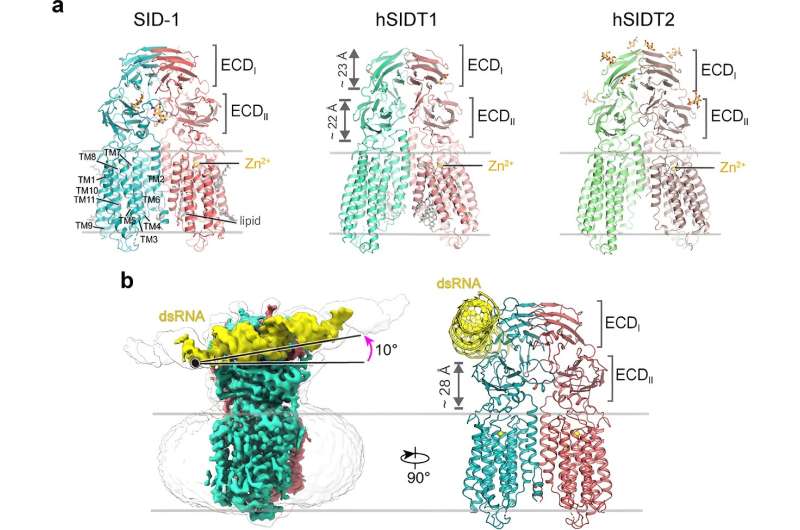
I mere end to årtier blev SID-1 anset for at fungere som en dsRNA-kanal. Her løste forskerne cryo-EM-strukturer i høj opløsning af SID-1 og de humane SID-1-homologer SIDT1 og SIDT2, hvilket afslørede den bevarede arkitektur af C. elegans og humane SID-1-homologer.
SID-1-homologerne er organiseret på en homodimer måde. Overraskende viser SID-1-dimeren ikke en tydelig pore i transmembrandomænet, hvilket tyder på, at SID-1 muligvis ikke fungerer som en dsRNA-kanal. MST-bindingsassays bekræftede, at SID-1 potent og specifikt kan binde til dsRNA, men ikke til dsDNA.
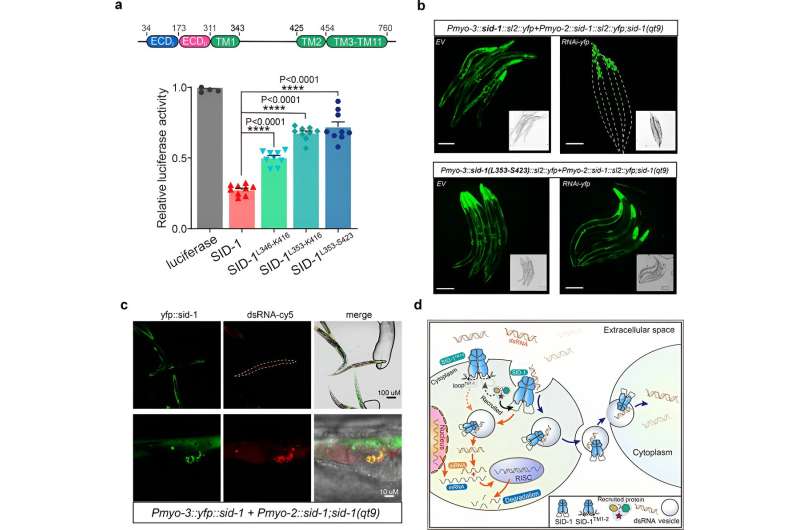
Efterfølgende opnåede forskerne cryo-EM-strukturen af SID-1-dsRNA-komplekset, hvilket demonstrerede den detaljerede dsRNA-bindingsmåde og de molekylære determinanter for, hvordan SID-1 adskiller dsRNA fra ssRNA og DNA.
Interessant nok er sådanne determinanter ikke til stede i human SIDT1 eller SIDT2. De strukturelle fund blev understøttet af mutageneseundersøgelser ved anvendelse af MST-bindingsassays, dsRNA-optagelse i S2-celler og in vivo systemiske RNAi-assays.
Endelig viser forskerne, at fjernelsen af de lange intracellulære løkke transmembrane helixer 1 og 2 ikke påvirkede SID-1-dimerisering, cellelokalisering eller dsRNA-binding, men det forringede signifikant dsRNA-optagelsen i S2-celler og systemisk RNAi i C. elegans.
Desuden afslørede co-lokalisering, at SID-1 og dsRNA co-lokaliseres i vesikellignende subcellulære organeller. Baseret på disse resultater foreslår forskerne, at SID-1 fungerer som en dsRNA-receptor og letter efterfølgende dsRNA-internalisering ved at rekruttere endocytisk-relaterede proteiner via den lange loop.
Flere oplysninger: Jiangtao Zhang et al., Strukturel indsigt i dobbeltstrenget RNA-genkendelse og transport af SID-1, Nature Structural &Molecular Biology (2024). DOI:10.1038/s41594-024-01276-9
Journaloplysninger: Naturens strukturelle og molekylære biologi
Leveret af Chinese Academy of Sciences
 Varme artikler
Varme artikler
-
 Iterativ udvikling:Udviklede Aldabra -skinnen to gange?Aldabra -skinnen, der lever på Aldabra Atoll i dag, er flyvefri, men de stammede fra en forfædres bestand af højtstående skyder. Charles J Sharp/Wikimedia Commons/CC BY-SA 4.0 Ude i Det Indiske Ocean
Iterativ udvikling:Udviklede Aldabra -skinnen to gange?Aldabra -skinnen, der lever på Aldabra Atoll i dag, er flyvefri, men de stammede fra en forfædres bestand af højtstående skyder. Charles J Sharp/Wikimedia Commons/CC BY-SA 4.0 Ude i Det Indiske Ocean -
 Konvergerer eller afviger arter, når de udvikler sig?Uafhængige arter kan antage lignende former, da de lever i den samme type miljø. Digital Vision/Thinkstock Venter ved busstoppestedet, du bemærker et levende mikrokosmos i græsset herunder. En myr tr
Konvergerer eller afviger arter, når de udvikler sig?Uafhængige arter kan antage lignende former, da de lever i den samme type miljø. Digital Vision/Thinkstock Venter ved busstoppestedet, du bemærker et levende mikrokosmos i græsset herunder. En myr tr -
 Hvilken værdi ved naturen? Lande har nu 1. retningslinjerFurnas vandkraftdæmning ligger langs Rio Grande-floden i Sao Jose da Barra, Brasilien, 1. september 2021. Lande har godkendt de første omfattende retningslinjer for vurdering af naturens værdi efter f
Hvilken værdi ved naturen? Lande har nu 1. retningslinjerFurnas vandkraftdæmning ligger langs Rio Grande-floden i Sao Jose da Barra, Brasilien, 1. september 2021. Lande har godkendt de første omfattende retningslinjer for vurdering af naturens værdi efter f -
 Hvordan gener deler deres arbejdsområdeKunstnerens indtryk af en adskilt organisatorisk enhed af DNA, et topologisk associerende domæne (TAD). I dataanalysen optræder disse domæner som trekanter, der kan omstruktureres i forskellige væv. K
Hvordan gener deler deres arbejdsområdeKunstnerens indtryk af en adskilt organisatorisk enhed af DNA, et topologisk associerende domæne (TAD). I dataanalysen optræder disse domæner som trekanter, der kan omstruktureres i forskellige væv. K
- Ozon- og disforurening svækker jordens kulstofoptagelse i Kina
- Tre løbske stjerner menes at være overlevende fra termonukleare eksplosioner
- Frankrig advarer Apple og Google om bøder for misbrug (opdatering)
- Forskere udfordrer påstande om, at sukkerindustrien flyttede skylden til fedt
- Top 10 gamle kinesiske opfindelser
- Undersøgelser undersøger marine hedebølger, skiftende havstrømme


