Nye mekanismer for spaltningsuafhængig aktivering af gasderminer afsløret
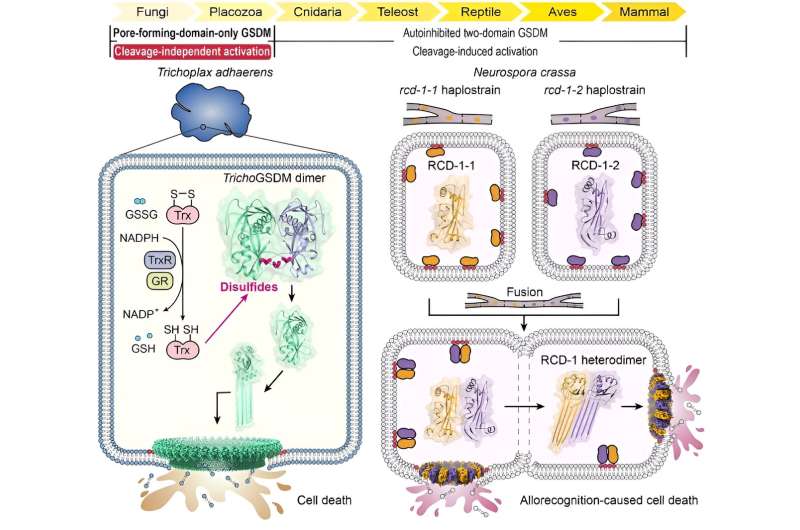
Pyroptose er en type programmeret celledød medieret af gasdermin (GSDM) proteinfamilien, som spiller vigtige roller i kroppens forsvar mod patogeninfektion, eliminering af unormale eller skadelige celler og andre processer. GSDM'er er en evolutionært konserveret klasse af poredannende proteiner, der er vidt udbredt blandt forskellige bakterier, svampe, hvirvelløse dyr og alle hvirveldyr.
GSDM'er har typisk en autohæmmet to-domæne struktur. Proteolytisk spaltning ser ud til at være en universel mekanisme til aktivering af alle GSDM'er. Hvorvidt der er andre aktiveringsmekanismer end proteasespaltning for GSDM'er er ukendt.
I en undersøgelse offentliggjort i Science , har forskere ledet af prof. Ding Jingjin fra Institut for Biofysik ved det kinesiske videnskabsakademi og prof. Shao Feng fra National Institute of Biological Sciences afsløret nye mekanismer til spaltningsuafhængig aktivering af to typer GSDM-proteiner fra lavere eukaryoter.
Gennem omfattende sekvenshomologianalyse identificerede forskerne først et GSDM-protein i den basale metazoan Trichoplax adhaerens (TrichoGSDM), der kun indeholder et poredannende domæne. Karakterisering af oprenset TrichoGSDM afslørede, at dette GSDM-protein eksisterer i to tilstande:monomer og homodimer, hvor kun det monomere protein har evnen til at danne porer på liposomer.
Strukturelle og biokemiske analyser afslørede, at den disulfidbundne homodimer repræsenterer den autoinhiberende tilstand af TrichoGSDM, som aktiveres til den monomere tilstand ved at reducere disulfidbindinger, yderligere oligomerisere og danne porer på cellemembranen for at inducere pyroptose-lignende celledød. Denne nye aktiveringsmekanisme, opdaget i TrichoGSDM, er den første af sin slags i hele GSDM-familien.
Derudover fokuserede forskerne på en anden type af poredannende domæne-only GSDM-protein kaldet RCD-1, som for nylig blev identificeret i den trådformede svamp Neurospora crassa. RCD-1 indeholder to homologe proteiner, RCD-1-1 og RCD-1-2 i forskellige stammer, der styrer allorecognition-induceret svampecelledød.
De fandt ud af, at membranbundne RCD-1-proteiner eksisterer i en inaktiv hviletilstand, når de efterlades alene. Men når forskellige stammer gennemgår cellefusion, støder de to RCD-1-proteiner på hinanden og samles til en heterodimer gennem specifik intermolekylær genkendelse, hvilket yderligere danner heterooligomere porer på cellemembranen for at udføre pyroptose-lignende celledød.
I denne undersøgelse repræsenterer TrichoGSDM og RCD-1 to typer af poredannende domæne-only GSDM'er afledt af simple og ældgamle eukaryoter, der bruger forskellige spaltningsuafhængige aktiveringsmekanismer.
TrichoGSDM er en disulfid-bundet autoinhiberet dimer og aktiveres ved reduktion af disulfiderne, hvilket tyder på en redox-responsiv funktion. Den poredannende aktivitet i RCD-1 stimuleres af hetero-genkendelse mellem RCD-1-1 og RCD-1-2 fra genetisk uforlignelige svampestammer, som ligger til grund for allorecognition-induceret celledød i N. crassa.
De forskellige aktiveringsmekanismer tyder på, at GSDM-proteiner kan reagere på en lang række fysiologiske signaler og deltage i flere biologiske processer. Desuden har disse poredannende domæne-only GSDM-proteiner potentialet til at blive udviklet som nye værktøjer til at inducere celledød uafhængigt af proteasespaltning, hvilket letter pyroptose-relateret grund- og translationsforskning.
Flere oplysninger: Yueyue Li et al, Spaltningsuafhængig aktivering af gamle eukaryote gasderminer og strukturelle mekanismer, Science (2024). DOI:10.1126/science.adm9190
Journaloplysninger: Videnskab
Leveret af Chinese Academy of Sciences
 Varme artikler
Varme artikler
-
 Afrikas ældste dinosaur fundet i ZimbabweSkelettet af Afrikas ældste dinosaur blev fundet under to ekspeditioner i 2017 og 2019. Forskere i Zimbabwe har opdaget resterne af Afrikas ældste dinosaur, som strejfede rundt på jorden for omkrin
Afrikas ældste dinosaur fundet i ZimbabweSkelettet af Afrikas ældste dinosaur blev fundet under to ekspeditioner i 2017 og 2019. Forskere i Zimbabwe har opdaget resterne af Afrikas ældste dinosaur, som strejfede rundt på jorden for omkrin -
 Forskere afslører ny krydstale mellem phytohormonerne ethylen og auxinInteraktionen mellem OsEIL1 og OsAux/IAAs regulerer ekspressionen af tryptophanaminotransferase MHZ10/OsTAR2 i risrødder for at fremme auxinbiosyntese. Kredit:IGDB Forskere ledet af prof. Zhang J
Forskere afslører ny krydstale mellem phytohormonerne ethylen og auxinInteraktionen mellem OsEIL1 og OsAux/IAAs regulerer ekspressionen af tryptophanaminotransferase MHZ10/OsTAR2 i risrødder for at fremme auxinbiosyntese. Kredit:IGDB Forskere ledet af prof. Zhang J -
 Forskere analyserer prisintervaller fra fodret kvæg forhandlet kontantsalgI kølvandet på hidtil usete markedschok i foderkvægindustrien gik forskere ved University of Tennessee Institute of Agriculture sammen med Mississippi State University og Texas A&M University for at a
Forskere analyserer prisintervaller fra fodret kvæg forhandlet kontantsalgI kølvandet på hidtil usete markedschok i foderkvægindustrien gik forskere ved University of Tennessee Institute of Agriculture sammen med Mississippi State University og Texas A&M University for at a -
 Forskere afslører, hvordan et vigtigt kræftmål kunne standse kræftspredningNuklear fascin bidrager til F-aktin bundtning. (A) Repræsentativt western blot af fascin knockdown (KD) HeLa celler, der udtrykker specificerede GFP-fascin konstruktioner udsat for biokemisk fraktione
Forskere afslører, hvordan et vigtigt kræftmål kunne standse kræftspredningNuklear fascin bidrager til F-aktin bundtning. (A) Repræsentativt western blot af fascin knockdown (KD) HeLa celler, der udtrykker specificerede GFP-fascin konstruktioner udsat for biokemisk fraktione
- Iran:årtiers uholdbar vandforbrug har tørret søer og forårsaget miljøødelæggelse
- Forskere afdækker jordskælvsbevægelsers rolle i udløsningen af en overraskende tsunami
- Guld-fosfor nanoplader katalyserer naturgas til grønnere energi selektivt
- Nye amerikanske regler vil kræve, at luftfartsselskaber skal fjerne kinesisk udstyr
- Uventet kilde til næringsstoffer fremmer væksten af giftige alger fra Lake Erie
- Studerende med handicap viser modstandskraft, der kunne vejlede post-pandemisk uddannelse


