Forskere dechifrerer, hvordan et enzym modificerer det genetiske materiale i cellekernen
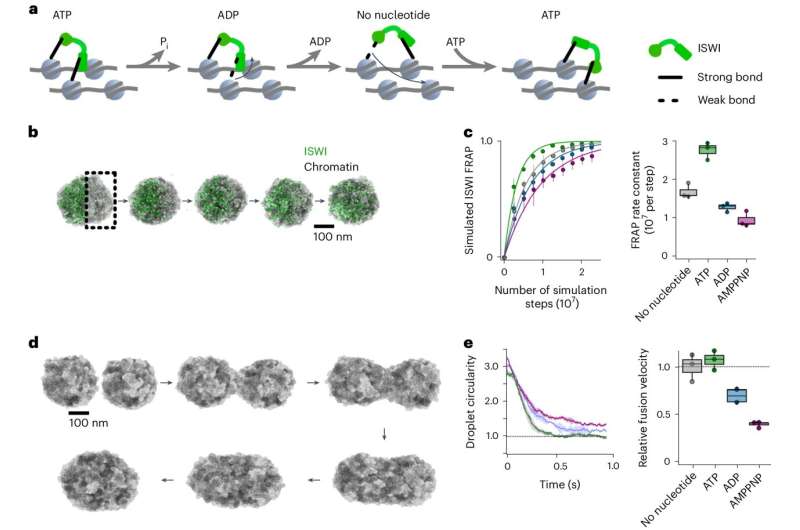
Inde i cellekernen findes DNA-molekylet i et tætpakket DNA-proteinkompleks kendt som kromatin. Her er DNA'et viklet omkring en kerne af histonproteiner og tæt pakket for at danne nukleosomer. Strukturen af nukleosomerne bestemmer, hvilke gener der er tilgængelige og aktive og spiller derfor en vigtig rolle i genreguleringen. For at reagere på metaboliske signaler, ændrede miljøforhold og udviklingsprocesser skal nukleosomerne gennemgå gentagne dynamiske modifikationer ved hjælp af enzymer.
Et hold ledet af professor Johannes Stigler fra LMU's Gencenter München i samarbejde med Felix Müller-Planitz (TU Dresden) har nu udført undersøgelser for at undersøge, hvordan et lillebitte kromatinmodificerende enzym kaldet ISWI forbliver mobilt på trods af det tætpakkede materiale i cellekernen og er i stand til effektivt at omarrangere nukleosomer.
Værket er publiceret i tidsskriftet Nature Structural &Molecular Biology .
Forskerne var i stand til at vise, at enzymet forbruger ATP – cellens energivaluta – ikke kun for dens enzymatiske aktivitet, men også for at navigere gennem cellekernen og for at forhindre kromatinen i at blive for stiv.
"Bevægelsen af ISWI gennem rummet tæt pakket med kromatin er drevet af ATP. Efterhånden som den skrider frem, bliver den ved med at docke skiftevis med forskellige bindingssteder på nukleosomerne. Vi sammenligner denne bevægelse med en abe, der svinger fra gren til gren," siger Stigler.
Ifølge forskerne kunne dechifreringen af disse processer give indsigt i, hvordan defekter bidrager til sygdomme og endda kunne åbne op for nye terapeutiske veje.
Flere oplysninger: Petra Vizjak et al., ISWI katalyserer nukleosomglidning i kondenserede nukleosomarrays, Nature Structural &Molecular Biology (2024). DOI:10.1038/s41594-024-01290-x
Journaloplysninger: Naturens strukturelle og molekylære biologi
Leveret af Ludwig Maximilian University of München
 Varme artikler
Varme artikler
-
 Nye arter af marine edderkopper dukker op ved lavvande for at minde forskerne om Bob MarleyLivsbillede af et kvindeligt individ af den nye art Desis bobmarleyi . Kredit:R. Raven Klokken var 02.00 den 11. januar 2009, da havet langs kysten af Australiens Sunshine State Queensland tra
Nye arter af marine edderkopper dukker op ved lavvande for at minde forskerne om Bob MarleyLivsbillede af et kvindeligt individ af den nye art Desis bobmarleyi . Kredit:R. Raven Klokken var 02.00 den 11. januar 2009, da havet langs kysten af Australiens Sunshine State Queensland tra -
 Frankrig vil modsætte sig EU's 5-årige fornyelse af ukrudtsmiddel glyphosatAktivister har opfordret til at forbyde glyphosat Frankrig vil modsætte sig et forslag fra Europa-Kommissionen om at forlænge godkendelsen af det kontroversielle ukrudtsbekæmpende glyphosat i fe
Frankrig vil modsætte sig EU's 5-årige fornyelse af ukrudtsmiddel glyphosatAktivister har opfordret til at forbyde glyphosat Frankrig vil modsætte sig et forslag fra Europa-Kommissionen om at forlænge godkendelsen af det kontroversielle ukrudtsbekæmpende glyphosat i fe -
 I takt med at chinook-laks bliver tyndere og færre, kæmper sydlige spækhuggere for at finde mad n…Kredit:Unsplash/CC0 Public Domain Efterhånden som marine arter fortsætter med at falde på verdensplan, har den sydlige fastboende spækhuggerbestand - som nu er på 75 individer - langs Nordamerikas
I takt med at chinook-laks bliver tyndere og færre, kæmper sydlige spækhuggere for at finde mad n…Kredit:Unsplash/CC0 Public Domain Efterhånden som marine arter fortsætter med at falde på verdensplan, har den sydlige fastboende spækhuggerbestand - som nu er på 75 individer - langs Nordamerikas -
 Projekt for at give offentlig adgang til højopløselige 3D-modeller af hvirveldyrs anatomioVert-projektet vil gøre det muligt at generere 3-D-modeller til uddannelse og outreach. Kredit:University of Kansas En ny indsats blandt 16 forskningsinstitutioner vil skabe høj opløsning, digita
Projekt for at give offentlig adgang til højopløselige 3D-modeller af hvirveldyrs anatomioVert-projektet vil gøre det muligt at generere 3-D-modeller til uddannelse og outreach. Kredit:University of Kansas En ny indsats blandt 16 forskningsinstitutioner vil skabe høj opløsning, digita
- Red Maple Tree Facts
- Sammenligning viser værdien af DNA-stregkodning ved udvælgelse af nanopartikler
- Er stjernespillere overvurderet i MLB? En nøglestatistik - vinder over erstatningsspiller - tåler …
- Stop med at skamme og begynd at give myndigheder:Annoncører skal gentænke deres budskab om plastaf…
- Kvanteinnovation fremmer billig alternativ solteknologi
- Søger ny fysik, forskere låner fra sociale netværk


