Forbedret CRISPR-metode muliggør stabil indsættelse af store gener i DNA fra højere planter
Forskere ved Leibniz Institute of Plant Biochemistry (IPB) er for første gang lykkedes med stabilt og præcist at indsætte store gensegmenter i DNA fra højere planter meget effektivt. For at gøre dette optimerede de genredigeringsmetoden CRISPR/Cas, almindeligvis kendt som "genetisk saks."
Den forbedrede CRISPR-metode giver store muligheder for målrettet modifikation af gener i højere planter, både til avl og forskning. Undersøgelsen, ledet af Prof. Alain Tissier og Dr. Tom Schreiber, er blevet offentliggjort i Molecular Plant .
CRISPR/Cas er en metode med et enormt potentiale til målrettet modifikation af individuelle gener. Det gælder dog ikke alle former for genetiske modifikationer, som opdrættere og videnskabsmænd har på deres ønskeliste. Mens den genetiske saks er ideel til at slå gener ud, det vil sige at slukke eller fjerne eksisterende gener, fungerer de ikke godt til præcist at indsætte gener eller erstatte gensegmenter. Hidtil har genetiske sakse været for ineffektive og derfor af ringe nytte til målrettet indsættelse af gener i DNA'et fra højere planter.
"Årsagen til dette er anlæggets interne reparationsmaskineri til DNA-brud," siger Schreiber. Disse reparationsenzymer er umiddelbart til stede, så snart der sker skade på DNA'et. De genkender også de glatte snit lavet af den genetiske saks og forbinder øjeblikkeligt de to afskårne DNA-strenge af den dobbelte helix. Denne sammenklæbning af det klippede DNA sker meget hurtigt og ikke særlig præcist; der er mindre tab af information, hvor bittesmå dele af DNA er tabt eller tilføjet.
"Disse unøjagtigheder er ikke et problem i knock-out-projekter og er endda ønskværdige," siger Schreiber, "fordi jeg vil slukke for genet alligevel. Men hvis jeg vil indsætte et gen, skal det gøres meget præcist. genetisk information skal indsættes nøjagtigt, der må ikke mangle en enkelt komponent, og ikke en enkelt ekstra komponent må integreres, ellers mister genet sin funktion, og hele eksperimentet var forgæves."
Af denne grund har CRISPR/Cas-medieret præcis og arfri indsættelse af større gener eller DNA-segmenter kun været vellykket i sjældne individuelle tilfælde til dato. For at øge succesraten for genindsættelse udstyrede Halle-forskerne den genetiske saks med et ekstra enzym, en såkaldt exonuklease.
Exonukleaser kan ændre DNA-spaltningsstederne skabt af den genetiske saks på en sådan måde, at cellens interne reparationsenzymer ikke længere kan genkende og reparere DNA-skaden. DNA-segmentet, der skal indsættes af CRISPR/Cas, ville derfor have tid nok til at integrere sig selv i den korrekte position gennem en anden, meget præcis, cellulær reparationsmekanisme.
I eksperimentet testede Halle-forskerne forskellige exonukleaser af viral, bakteriel, plante- og menneskelig oprindelse for deres evne til at øge antallet af præcise genindsættelsesbegivenheder. De introducerede den genetiske saks med de tilsvarende exonukleaser og et gen X-segment i bladcellerne på tobaksplanten Nicotiana benthamiana.
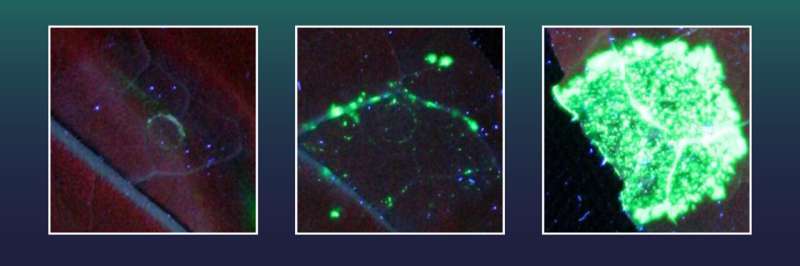
Disse tobaksceller var tidligere blevet udstyret med et gen for en grøn fluorescerende markør. De indeholdt også et ødelagt gen X, som er nødvendigt for dannelsen af det grønne fluorescerende farvestof. Den fluorescerende markør kan dog ikke genereres, så længe en stor del af gen X's genetiske information mangler.
Den grønne markør kan kun produceres, når den manglende gensektion af X genindsættes præcist ved hjælp af CRISPR/Cas, og dermed reparere gen X. Hver celle med vellykket genindsættelse vil derefter fluorescere i grønt, og forskerne kan simpelthen tælle antallet af vellykkede genindsættelseshændelser .
To af de testede exonukleaser, herunder en fra herpesvirusfamilien, viste sig at være særligt effektive. Ved at bruge disse opnåede holdet fra Halle 38 gange flere perfekte genindsættelsesbegivenheder end med CRISPR/Cas alene.
Denne eksperimentelle tilgang blev derefter testet med andre gener, der skulle inkorporeres og i andre planter, nemlig thalekarse (Arabidopsis thaliana) og hvede. Da genindsættelsen i tobaksplanterne kun fandt sted lokalt i bladene, gik det integrerede gen tabt i næste dattergeneration og var derfor kun til stede i genomet i en begrænset periode.
Det er grunden til, at Halle CRISPR-eksperterne i Arabidopsis og hvede forsøgte at inkorporere genet i kimcelleceller for at sikre en stabil arv til fremtidige plantegenerationer. Ved hjælp af de testede exonukleaser viste den stabile, dvs. arvelige, knock-in af gener sig vellykket i Arabidopsis med en tidoblet stigning i frekvens og i hvede i mere end 1 % af datterplanterne.
"Én procent lyder umiddelbart ikke af meget," forklarer Schreiber, "men hvis en opdrætter ønsker at introducere en bestemt egenskab i sin plante, skal han kun screene omkring 50-100 førstegenerations datterplanter ved hjælp af vores optimerede CRISPR /Cas-metoden til at finde en plante med den ønskede egenskab Dette ville spare en betydelig mængde tid sammenlignet med konventionelle forædlingsmetoder, hvor 500 til 1.000 planter skulle analyseres til dette formål."
Derfor er den optimerede CRISPR/Cas-metode et lovende værktøj til målrettet indsættelse af gener i højere planter og muligvis også i andre organismer. Planteavlere kunne i fremtiden bruge denne metode til for eksempel at genindføre tabte resistensgener mod patogener fra vilde arter eller gamle dyrkede sorter i moderne, højtydende elitesorter. På den måde kunne ønskværdige egenskaber som disse forbedre planteavl og bidrage til udviklingen af mere robuste afgrødesorter.
For videnskaben giver denne tilgang store muligheder for elegant at erstatte visse plantegener med modificerede kopier af sig selv i et enkelt trin. Dette er især nyttigt til at belyse genfunktion.
Flere oplysninger: Tom Schreiber et al., Effektiv arfri knock-ins af adskillige kilobaser i planter af konstruerede CRISPR-Cas endonukleaser, Molecular Plant (2024). DOI:10.1016/j.molp.2024.03.013
Journaloplysninger: Molekylær plante
Leveret af Institut für Pflanzenbiochemie
 Varme artikler
Varme artikler
-
 Hvordan celler bliver uafhængige og regulerer funktionerKredit:Pixabay/CC0 Public Domain Jacob Lewerentz, Institut for Molekylærbiologi ved Umeå Universitet, bidrager med sit speciale til viden om, hvordan celler regulerer deres proteinniveau og tilpass
Hvordan celler bliver uafhængige og regulerer funktionerKredit:Pixabay/CC0 Public Domain Jacob Lewerentz, Institut for Molekylærbiologi ved Umeå Universitet, bidrager med sit speciale til viden om, hvordan celler regulerer deres proteinniveau og tilpass -
 Disse ringhale-lemurer stinker, når de flirter med potentielle kammeraterKredit:Devin Sturgeon/University of Toronto En U of T Scarborough-undersøgelse finder, at et unikt ritual udført af ringhale-mandlige lemurer kan have betydelige fysiske omkostninger, men det kunn
Disse ringhale-lemurer stinker, når de flirter med potentielle kammeraterKredit:Devin Sturgeon/University of Toronto En U of T Scarborough-undersøgelse finder, at et unikt ritual udført af ringhale-mandlige lemurer kan have betydelige fysiske omkostninger, men det kunn -
 Hemmeligheder bag sukkulenter vandmæssige måder afsløretKalanchoë fedtschenkoi. Kredit:Dr. James Hartwell Planteforskere ved University of Liverpool har afsløret ny indsigt i de mekanismer, der gør det muligt for visse planter at spare vand og tolerere
Hemmeligheder bag sukkulenter vandmæssige måder afsløretKalanchoë fedtschenkoi. Kredit:Dr. James Hartwell Planteforskere ved University of Liverpool har afsløret ny indsigt i de mekanismer, der gør det muligt for visse planter at spare vand og tolerere -
 DNA slår et århundredegammelt mysterium om New Zealands kun uddøde ferskvandsfiskEt eksempel på en formalinfikseret New Zealand-harr, fanget i Clutha-floden (1874). Kredit:Otago Museum CC BY 4.0, Forfatter leveret I 1923 dokumenterede Te Rangi Hīroa (Sir Peter Buck) den sidste
DNA slår et århundredegammelt mysterium om New Zealands kun uddøde ferskvandsfiskEt eksempel på en formalinfikseret New Zealand-harr, fanget i Clutha-floden (1874). Kredit:Otago Museum CC BY 4.0, Forfatter leveret I 1923 dokumenterede Te Rangi Hīroa (Sir Peter Buck) den sidste
- Molekyleundersøgelser afslører potentiel behandling for patienter med slagtilfælde
- 'Politikere i klæder':Hvordan en skarp højresving satte tillid til Højesteret i fare
- Hvorfor har vi brug for skarpere vejr- og klimamodeller?
- Luftforurening vender tilbage til niveauet før COVID
- Hvilke funktioner har Alveoli i lungerne?
- Fem hovedorgansystemer i kroppen


