Forskere afslører detaljer om, hvordan bakterier bygger beskyttende barrierer, kan informere nye antibiotika
Yale-forskere har afsløret nye detaljer om, hvordan bakterier som E. coli bygger deres beskyttende barrierer, hvilket vil informere om ny udvikling af antibiotika.
Antibiotika-resistente bakterier er et voksende problem, når det kommer til at bekæmpe infektioner. Bakterier, der har et ekstra beskyttende lag på deres cellevægge – en type kendt som "Gram-negative" med henvisning til den farvningsmetode, der bruges til at identificere det – er særligt vanskelige at bekæmpe.
Yale-forskere har gjort fremskridt med at forstå, hvordan bakterier genererer dette beskyttende lag gennem en ny undersøgelse, der afslører yderligere nuancer – og yderligere mål for udvikling af nye antibiotika.
Deres resultater blev offentliggjort den 18. april i Proceedings of the National Academy of Sciences .
En kritisk komponent i dette beskyttende lag er et molekyle kaldet lipopolysaccharid (LPS). Bakterier har brug for en vis mængde LPS; for meget eller for lidt dræber cellen. Tidligere forskning fra laboratoriet hos Wei Mi, assisterende professor i farmakologi ved Yale School of Medicine, afslørede, hvordan molekylære sensorer i E. coli opnår den rette balance mellem LPS-produktion.
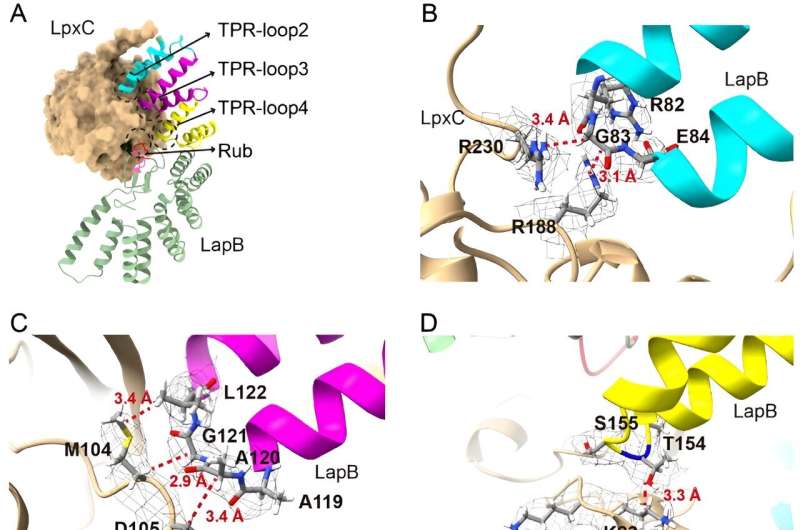
I den nye undersøgelse dykkede forskere dybere ned i den del af denne proces, der forhindrer overskydende LPS-opbygning, med det formål at afklare, hvordan et protein kaldet LapB binder til og stimulerer nedbrydningen af LpxC, et enzym, der starter LPS-produktionen. Forskerne brugte kryogen elektronmikroskopi til at se strukturen af det kompleks, der dannes, når disse to molekyler bindes.
"At se på strukturen giver den mest direkte visualisering af, hvordan denne del af processen sker," sagde Mi, seniorforfatter af den nye undersøgelse. "Når vi så strukturen, lavede vi ændringer i molekylerne for at se, hvordan den påvirkede bindingen, hvilket gjorde det muligt for os at identificere, hvilke komponenter der er nødvendige for, at LapB kan genkende LpxC."
Men forskerne fandt også til deres overraskelse, at LapB havde en anden rolle. Det er ikke kun ansvarligt for nedbrydningen af LpxC, men det hæmmer også enzymets virkning, før nedbrydningen sker.
"Dybest set lukker LapB LpxC ned, før den kasserer den," sagde Mi. "Vi forstår ikke, hvorfor bakterier gør dette, da det virker overflødigt, men det er det, vi undersøger nu."
Forskerne spekulerer i, at denne dobbeltrolle kan handle om fleksibilitet. Nedbrydning er en langsom, men irreversibel proces, hvorimod hæmning er hurtig og reversibel. At have begge egenskaber kan gøre det muligt for bakterier at reagere mere smidigt på miljøændringer.
"Dette er alt sammen relevant for udvikling af antibiotika," sagde Mi. "Disse detaljer vil hjælpe os med at finde nye tilgange og forstå, hvorfor andre ikke virker."
Flere oplysninger: Sheng Shu et al, Dual function of LapB (YciM) i regulering af Escherichia coli lipopolysaccharidsyntese, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2321510121
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af Yale University
Sidste artikelFugleinfluenza-udbrud rejser et foruroligende spørgsmål
Næste artikelPlanlægning i flere skalaer for sunde koraller og samfund
 Varme artikler
Varme artikler
-
 Majsgenetikforskning afslører mekanismen bag træk, der bliver tavseDiverse majskolber, der viser de forskellige genetiske egenskaber ved kerne- og kolberfarver. Kredit:Surinder Chopra, Penn State I mere end et århundrede, plantegenetikere har studeret majs som et
Majsgenetikforskning afslører mekanismen bag træk, der bliver tavseDiverse majskolber, der viser de forskellige genetiske egenskaber ved kerne- og kolberfarver. Kredit:Surinder Chopra, Penn State I mere end et århundrede, plantegenetikere har studeret majs som et -
 Et kung-fu-kick førte forskere til verdens ældste komplette fiskefossiler. Her er, hvad de fandtKredit:Heming Zhang, Forfatter leveret Nogle af verdens mest betydningsfulde fossilfund er kommet fra Kina. Disse omfatter fantastiske fjerbeklædte dinosaurer, de tidligste moderne pattedyr og nogl
Et kung-fu-kick førte forskere til verdens ældste komplette fiskefossiler. Her er, hvad de fandtKredit:Heming Zhang, Forfatter leveret Nogle af verdens mest betydningsfulde fossilfund er kommet fra Kina. Disse omfatter fantastiske fjerbeklædte dinosaurer, de tidligste moderne pattedyr og nogl -
 Ligger fisk af iltsult?Baseret på deres indsigt har forskerne identificeret - meget detaljeret og på verdensplan - hvilke fisk der sandsynligvis vil trives i hvilke vandområder, fra oceaner til små floder. Vi har beregnet d
Ligger fisk af iltsult?Baseret på deres indsigt har forskerne identificeret - meget detaljeret og på verdensplan - hvilke fisk der sandsynligvis vil trives i hvilke vandområder, fra oceaner til små floder. Vi har beregnet d -
 Er lykke smitsom?Smil, Kevin Bacon! Lykken i dit sociale netværk afhænger af det! Evan Agostini/Getty Images Efter at skuespilleren Kevin Bacon i et interview kommenterede, at han havde arbejdet med alle i Hollywood,
Er lykke smitsom?Smil, Kevin Bacon! Lykken i dit sociale netværk afhænger af det! Evan Agostini/Getty Images Efter at skuespilleren Kevin Bacon i et interview kommenterede, at han havde arbejdet med alle i Hollywood,
- Fysiske og kemiske egenskaber ved natriumbicarbonat
- Jernrige lameller i en halvleder
- Hubble udforsker dannelsen og udviklingen af stjernehobe i den store magellanske sky
- Ultratynde spraypåførte MXene-antenner er klar til 5G
- Hvorfor kinesisk videnskab virker så hemmelighedsfuld – og hvordan den kan være ved at ændre sig
- Kan hurtige radioudbrud frembringes af kollisioner mellem neutronstjerner og asteroider?


