Forskere giver bevis for, hvordan proteiner folder
Proteiner er essentielle for livet. De udfører en lang række funktioner, herunder at katalysere kemiske reaktioner, transportere molekyler og yde strukturel støtte. Hvordan proteiner foldes til deres funktionelle former er et grundlæggende spørgsmål i biologi.
I en ny undersøgelse har forskere ved University of California, Berkeley, fremlagt beviser for en mekanisme kaldet "nukleation-kollaps". Nukleation-kollaps foreslår, at proteiner folder ved først at danne en lille, stabil kerne af aminosyrer. Denne kerne vokser derefter ved at tiltrække andre aminosyrer, hvilket får proteinet til at kollapse til sin endelige form.
Forskerne testede deres hypotese ved hjælp af et protein kaldet det grønne fluorescerende protein (GFP). GFP er et lille protein, der lyser grønt, når det udsættes for blåt lys. Forskerne konstruerede en version af GFP, der indeholdt en enkelt aminosyresubstitution. Denne substitution gjorde proteinet mere tilbøjeligt til at danne en stabil kerne.
Forskerne fandt ud af, at den konstruerede GFP foldede sig meget hurtigere end vildtype GFP. Dette tyder på, at nukleation-kollaps er en nøglemekanisme for proteinfoldning.
Resultaterne af denne undersøgelse har betydning for forståelsen af, hvordan proteiner folder forkert. Proteinfejlfoldning kan føre til en række sygdomme, herunder Alzheimers sygdom og cystisk fibrose. Ved at forstå, hvordan proteiner folder sig, kan forskere muligvis udvikle nye lægemidler til at forebygge eller behandle disse sygdomme.
Undersøgelsen blev offentliggjort i tidsskriftet Nature Structural &Molecular Biology.
Sidste artikelForskere sammensætter, hvordan proteiner folder
Næste artikelHvordan nulstiller kropstemperaturen det biologiske ur?
 Varme artikler
Varme artikler
-
 En bedre forståelse af afgrødeudbytte under klimaændringerKredit:Joran Quinten på Unsplash Du behøver ikke en ph.d. i landbruget at vide, at vand er afgørende for afgrødeproduktionen. Men i årevis har folk som Jonathan Proctor, der har en ph.d. i Agricult
En bedre forståelse af afgrødeudbytte under klimaændringerKredit:Joran Quinten på Unsplash Du behøver ikke en ph.d. i landbruget at vide, at vand er afgørende for afgrødeproduktionen. Men i årevis har folk som Jonathan Proctor, der har en ph.d. i Agricult -
 Hvorfor får dæmoner skylden for søvnlammelse?En inkubus sætter sig på hug på en drømmers bryst i Henry Fuselis ikoniske maleri Mareridtet fra 1781. Fine Art Images/Heritage Images/Getty I Bogen om imaginære væsener, Jorge Luis Borges beskriver
Hvorfor får dæmoner skylden for søvnlammelse?En inkubus sætter sig på hug på en drømmers bryst i Henry Fuselis ikoniske maleri Mareridtet fra 1781. Fine Art Images/Heritage Images/Getty I Bogen om imaginære væsener, Jorge Luis Borges beskriver -
 Dette videnskabelige eksperiment vil køre i 500 årHætteglas med bakterier til 500-års eksperimentet er vist. Sporerne tørres ned på siliciumperle -ekssikkatorer, før de forsegles. Ulrich et al., PLOS One, 2018 Nogle typer bakterier er kendt for dere
Dette videnskabelige eksperiment vil køre i 500 årHætteglas med bakterier til 500-års eksperimentet er vist. Sporerne tørres ned på siliciumperle -ekssikkatorer, før de forsegles. Ulrich et al., PLOS One, 2018 Nogle typer bakterier er kendt for dere -
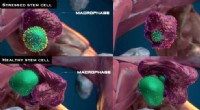 Lyver kvalitetssikring af nye stamceller:Makrofager foretager undersøgelsenDe to øverste paneler viser en stresset stamcelle, som angivet ved, at calreticulinet udtrykt på dens overflade (gule pigge), bliver opslugt og spist af en makrofag. De to nederste paneler viser en su
Lyver kvalitetssikring af nye stamceller:Makrofager foretager undersøgelsenDe to øverste paneler viser en stresset stamcelle, som angivet ved, at calreticulinet udtrykt på dens overflade (gule pigge), bliver opslugt og spist af en makrofag. De to nederste paneler viser en su
- NanoRacks CEO diskuterer tendenser inden for kommerciel rumhardware
- Super grafen kan hjælpe med at behandle kræft
- Hvordan kappebevægelser former jordens overflade
- Udtalelse:Elever med handicap bør have mulighed for personlig læring under COVID-19 skolelukninger
- Alsidig lysstyring i WSe₂ opnået
- Svævende partikler i et vakuum


