Hvad bestemmer styrken af en arrheniusbase?
1. Dissociationskonstant (Kb): Dissociationskonstanten (Kb) er et kvantitativt mål for basens dissociationsstyrke. Det repræsenterer ligevægtskonstanten for dissociationsreaktionen af basen i vand. En højere Kb-værdi indikerer en større tendens for basen til at dissociere og frigive hydroxidioner, hvilket gør den til en stærkere base.
2. ionisk ladning: Den ioniske ladning af basens kation spiller også en rolle i at bestemme dens styrke. Kationer med højere positive ladninger har en tendens til at stabilisere den negative ladning af hydroxidioner frigivet af basen. Som et resultat er baser med højt ladede kationer generelt stærkere. For eksempel er KOH (kaliumhydroxid) en stærkere base end NaOH (natriumhydroxid), fordi K+ har en højere ladning (+1) sammenlignet med Na+ (+1).
3. Ionisk størrelse: Ionstørrelsen af basens kation påvirker styrken af basen. Større kationer har en lavere ladningstæthed, hvilket betyder, at de interagerer mindre stærkt med hydroxidionerne. Denne svagere interaktion gør det muligt for basen at dissociere mere omfattende, hvilket fører til en stærkere base. For eksempel er CsOH (cesiumhydroxid) en stærkere base end KOH, fordi Cs+ er større og har en lavere ladningsdensitet end K+.
4. Hydreringsenergi: Hydratiseringsenergien af basens kation påvirker også dens styrke. Hydrationsenergi refererer til den energi, der frigives, når ioner er omgivet af vandmolekyler. Kationer med højere hydreringsenergi har en tendens til at blive stærkere tiltrukket af vandmolekyler, hvilket reducerer interaktionen med hydroxidioner. Som følge heraf er baser med kationer, der har højere hydreringsenergi, generelt svagere.
5. Anionens opløsning: Solvatiseringen af den konjugerede base (anionen dannet efter dissociation) påvirker også styrken af basen. Anioner, der lettere opløses af vandmolekyler, er mere stabile, hvilket fremmer dissociationen af basen og øger dens styrke.
6. Strukturelle effekter: Den molekylære struktur og funktionelle grupper til stede i basen kan påvirke dens styrke. Visse funktionelle grupper, såsom elektrontiltrækkende grupper, kan lette dissociationen af basen ved at stabilisere den konjugatbase.
Ved at overveje disse faktorer er det muligt at forstå og forudsige de relative styrker af Arrhenius baser. Styrken af en base er afgørende i forskellige kemiske og biologiske processer, herunder syre-base reaktioner, pH-regulering og katalyse.
 Varme artikler
Varme artikler
-
 Nyt håb for kritisk truet Myanmar snudenæseabeSpædbarn Myanmar eller sort abe med snudenæse. Kredit:Shaohua Dong Otte år efter opdagelsen af en ny primatart i Myanmar, videnskabsmænd har udgivet en ny rapport, der afslører, hvordan det går
Nyt håb for kritisk truet Myanmar snudenæseabeSpædbarn Myanmar eller sort abe med snudenæse. Kredit:Shaohua Dong Otte år efter opdagelsen af en ny primatart i Myanmar, videnskabsmænd har udgivet en ny rapport, der afslører, hvordan det går -
 Mystisk jordvirusgen set for første gangKrystaller af jordvirus AMG-produktet (chitosanase) ved 400x forstørrelse. Individuelle krystaller blev kryoafkølet i flydende nitrogen, før de blev udsat for de kraftige SSRL røntgenstråler til struk
Mystisk jordvirusgen set for første gangKrystaller af jordvirus AMG-produktet (chitosanase) ved 400x forstørrelse. Individuelle krystaller blev kryoafkølet i flydende nitrogen, før de blev udsat for de kraftige SSRL røntgenstråler til struk -
 Den første mærkning af Amazonas delfiner nogensinde for at øge bevaringsindsatsenKredit:Jaime Rojo / WWF-UK For første gang nogensinde, WWF og forskningspartnere sporer nu floddelfiner i Amazonas ved hjælp af satellitteknologi, efter at forskere med succes har mærket delfiner
Den første mærkning af Amazonas delfiner nogensinde for at øge bevaringsindsatsenKredit:Jaime Rojo / WWF-UK For første gang nogensinde, WWF og forskningspartnere sporer nu floddelfiner i Amazonas ved hjælp af satellitteknologi, efter at forskere med succes har mærket delfiner -
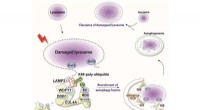 Molekylære tags afslører, hvordan beskadigede lysosomer udvælges og markeres til clearanceLysosomet er en sur intracellulær organel, der er afgørende for nedbrydning af forskellige cellulære komponenter. Ved lysosomal membranbeskadigelse frigives lysosomale hydrolaser til cytosolen og indu
Molekylære tags afslører, hvordan beskadigede lysosomer udvælges og markeres til clearanceLysosomet er en sur intracellulær organel, der er afgørende for nedbrydning af forskellige cellulære komponenter. Ved lysosomal membranbeskadigelse frigives lysosomale hydrolaser til cytosolen og indu
- Billede:NASA ser Mount Agungs askesky over Balihavet
- Kemikere forbedrer metoden til at udvinde naturlige antioxidanter fra laurbærblade
- Hvordan virker lavalamper? Videnskaben bag Liquid Motion
- Hvad Voyager-rumsonderne kan lære menneskeheden om udødelighed og arv
- Indfanger adfærden af enkeltatom-katalysatorer på farten
- Forskere udvikler en ny klasse af plante nanobioniske sensorer til at overvåge arsenniveauer i jord…


