Hvilke faktorer påvirker driften af enzymer, og hvorfor?
Faktorer, der påvirker enzymdrift:
Enzymer er biologiske katalysatorer, der accelererer kemiske reaktioner uden at blive konsumeret i processen. Deres aktivitet er påvirket af flere faktorer, der hver især påvirker enzymets effektivitet og reaktionshastighed:
1. Temperatur:
* optimal temperatur: Hvert enzym har en optimal temperatur, hvor det fungerer bedst.
* Forøget temperatur: Forøget temperatur øger generelt reaktionshastighed, indtil det optimale er nået. Ud over det optimale begynder enzymstrukturen at denature (udfolde sig), hvilket fører til et tab af aktivitet.
* Nedsat temperatur: Lavere temperaturer bremser reaktionshastigheden. Molekylerne har mindre kinetisk energi, og kollisioner er mindre hyppige.
2. Ph:
* optimal pH: Enzymer har også en optimal pH, hvor de fungerer bedst.
* afvigelse fra optimal pH: Ændringer i pH kan påvirke ioniseringstilstanden for aminosyrer i enzymet, ændre dets form og forstyrre dens evne til at binde til underlaget. Dette kan forårsage et fald i aktiviteten.
3. Substratkoncentration:
* lavt underlagskoncentration: Ved lave substratkoncentrationer øges reaktionshastigheden proportionalt med stigende substratkoncentration. Dette skyldes, at flere substratmolekyler er tilgængelige til at binde til enzymet.
* Høj substratkoncentration: Når substratkoncentrationen stiger, når reaktionshastigheden til sidst et plateau (mætning). Dette forekommer, fordi alle de enzym aktive steder er mættet med substratmolekyler.
* Michaelis-Menten Constant (KM): Denne værdi repræsenterer den substratkoncentration, hvorpå enzymet fungerer med halvdelen af sin maksimale hastighed.
4. Enzymkoncentration:
* Direkte forhold: Reaktionshastigheden er direkte proportional med enzymkoncentrationen. Flere enzymmolekyler betyder mere aktive steder, der er tilgængelige for at binde til underlaget.
5. Inhibitorer:
* Konkurrencedygtige hæmmere: Disse hæmmere binder til det aktive sted for enzymet, der konkurrerer med substratet til binding. De bremser reaktionshastigheden, men ændrer ikke den maksimale hastighed.
* Ikke-konkurrencedygtige hæmmere: Disse hæmmere binder til et sted på enzymet forskellig fra det aktive sted, ændrer enzymets form og reducerer dets aktivitet. De reducerer den maksimale sats, men påvirker ikke KM.
6. Aktivatorer:
* kationer: Nogle enzymer kræver tilstedeværelsen af specifikke kationer (f.eks. Mg2+, Ca2+) for aktivitet. Disse kationer kan hjælpe med at stabilisere enzymstrukturen eller deltage i den katalytiske mekanisme.
7. Cofaktorer og coenzymer:
* kofaktorer: Ikke-proteinmolekyler, der er essentielle for nogle enzymers aktivitet. De kan være metalioner eller organiske molekyler.
* coenzymer: Organiske kofaktorer, der binder til enzymet og deltager i den katalytiske proces. Eksempler inkluderer NAD+, FAD og Coenzyme A.
Hvorfor disse faktorer påvirker enzymdrift:
Disse faktorer påvirker enzymdrift, fordi de påvirker enzymets:
* struktur: Temperatur, pH og hæmmere kan påvirke enzymets tredimensionelle struktur, som er afgørende for dens funktion.
* Aktivt sted: Det aktive sted er det område, hvor underlaget binder. Ændringer i enzymets struktur kan ændre det aktive sted, hvilket påvirker dets evne til at binde underlaget.
* katalytisk mekanisme: De specifikke kemiske reaktioner, der er katalyseret af et enzym, påvirkes af enzymets struktur og dets interaktion med cofaktorer og coenzymer.
Sammenfattende er forståelse af disse faktorer afgørende for at forstå, hvordan enzymer fungerer, og hvordan deres aktivitet kan moduleres under forskellige forhold. Denne viden er vigtig for at studere biologiske processer og for at udvikle nye lægemidler og terapier.
 Varme artikler
Varme artikler
-
 Sådan fungerer kønsskifteoperationChristine Jorgensen var en tidligere GI og en af de første amerikanere, der gennemgik kirurgisk kønsskifte. New York Daily News Archive/Getty Images I 1952 en 27-årig, tidligere GI fra anden verden
Sådan fungerer kønsskifteoperationChristine Jorgensen var en tidligere GI og en af de første amerikanere, der gennemgik kirurgisk kønsskifte. New York Daily News Archive/Getty Images I 1952 en 27-årig, tidligere GI fra anden verden -
 Stammer religionerne fra vores misforståelse af menneskelig bevidsthed?Computerkunstværk set forfra af en menneskelig hjerne. I baggrunden et neuralt netværk af nerveceller, der affyrer. Science Photo Library - PASIEKA/Getty Images Mennesker har påstået at høre Guds ste
Stammer religionerne fra vores misforståelse af menneskelig bevidsthed?Computerkunstværk set forfra af en menneskelig hjerne. I baggrunden et neuralt netværk af nerveceller, der affyrer. Science Photo Library - PASIEKA/Getty Images Mennesker har påstået at høre Guds ste -
 Karpevirussen, der lærte forskere om immunologiTi års forskning i en karpevirus har afsløret nye perspektiver på virkningsmekanismerne af cellulære proteiner involveret i alvorlige patologier. Kredit:Dan Nacu Et af de fascinerende aspekter af v
Karpevirussen, der lærte forskere om immunologiTi års forskning i en karpevirus har afsløret nye perspektiver på virkningsmekanismerne af cellulære proteiner involveret i alvorlige patologier. Kredit:Dan Nacu Et af de fascinerende aspekter af v -
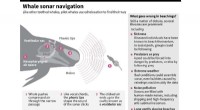 Hvalstrandinger:Fem spørgsmål besvaretGrafisk ser på, hvordan grindehvaler bruger ekkolokalisering til at navigere under vandet, og opremser forskellige teorier om, hvad der kunne gå galt og føre til strandinger. Omkring 200 grindehval
Hvalstrandinger:Fem spørgsmål besvaretGrafisk ser på, hvordan grindehvaler bruger ekkolokalisering til at navigere under vandet, og opremser forskellige teorier om, hvad der kunne gå galt og føre til strandinger. Omkring 200 grindehval
- Hvilken syre er en stærk elektrolyt A. svovlsyre B. eddikesyre C. myresyre D. citronsyre?
- Hvad er den vådeste biome på jorden?
- Hvilken side af bjerget betragtes som vindt?
- Hvad er funktionen af et anemometer?
- Chloridion og kloratom har hvor mange elektronkonfigurationer?
- Hvad kaldes mod urets spin af en planet eller måne?


