Hvad er den halve celle -reaktion af almindelig tørcelle?
anode (negativ elektrode):
* Oxidation: Zn (S) → Zn²⁺ (aq) + 2e⁻
katode (positiv elektrode):
* reduktion: 2mno₂ (s) + 2H⁺ (aq) + 2e⁻ → mn₂o₃ (s) + h₂o (l)
samlet reaktion:
Zn (s) + 2mno₂ (s) + 2H⁺ (aq) → Zn²⁺ (aq) + mn₂o₃ (s) + h₂o (l)
Forklaring:
* anode (zink): Zinkelektroden oxideres, hvilket betyder, at den mister elektroner og danner zinkioner (Zn²⁺). Disse elektroner strømmer gennem det ydre kredsløb til katoden.
* katode (mangandioxid): Mangandioxid (MNO₂) reduceres, hvilket betyder, at det får elektroner. Elektronerne reagerer med Mno₂, vand og hydrogenioner (H⁺) for at danne mangan (III) oxid (Mn₂O₃) og vand. Hydrogenionerne kommer fra ammoniumchlorid (NH₄CL) elektrolyt.
Bemærk:
* Den tørre celle er ikke rigtig "tør", da den indeholder en fugtig pastaelektrolyt.
* Elektrolytten er en blanding af ammoniumchlorid (NH₄CL) og zinkchlorid (ZnCl₂).
* Reaktionen er ikke fuldt reversibel, hvilket gør den tørre celle til en primær celle (ikke-genopladelig).
Sidste artikelHvad er termbocytter?
Næste artikelHvorfor skal hver celle i kroppen have genetisk materiale inde i det for at arbejde?
 Varme artikler
Varme artikler
-
 Hvad resulterede af at fodre søkøer med 100 tons salat? Embedsmænd overvejer lektierKredit:Pixabay/CC0 Public Domain Nødfodringen og redningen af sultende søkøer i det centrale Florida er blevet demobiliseret, og myndighederne undrer sig nu over erfaringer, bortset fra én. Mang
Hvad resulterede af at fodre søkøer med 100 tons salat? Embedsmænd overvejer lektierKredit:Pixabay/CC0 Public Domain Nødfodringen og redningen af sultende søkøer i det centrale Florida er blevet demobiliseret, og myndighederne undrer sig nu over erfaringer, bortset fra én. Mang -
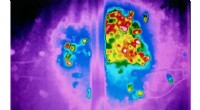 Hvordan glyphosat påvirker yngelpleje hos humlebierTermisk billede af den delte humlebikoloni:venstre med glyphosat, højre ubehandlet. Kredit:Anja Weidenmüller Humlebikolonier udsat for glyphosat påvirkes betydeligt i tider med ressourceknaphed. Dr
Hvordan glyphosat påvirker yngelpleje hos humlebierTermisk billede af den delte humlebikoloni:venstre med glyphosat, højre ubehandlet. Kredit:Anja Weidenmüller Humlebikolonier udsat for glyphosat påvirkes betydeligt i tider med ressourceknaphed. Dr -
 FN disker op med figenkaktus som svar på fødevaresikkerhedKaktussen blev betragtet som hellig af de gamle aztekere, og nutidens mexicanere spiser det, drik det, og endda bruge det i medicin og shampoo Kaktuskaktus, betragtes som en vigtig fødevare i Mexi
FN disker op med figenkaktus som svar på fødevaresikkerhedKaktussen blev betragtet som hellig af de gamle aztekere, og nutidens mexicanere spiser det, drik det, og endda bruge det i medicin og shampoo Kaktuskaktus, betragtes som en vigtig fødevare i Mexi -
 Hvorfor du skal være opmærksom på flueopkastKredit:Pixabay/CC0 Public Domain Ny forskning fra University of Massachusetts Amherst vedrørende synantropiske fluer - eller de ikke-bidende fluer, der lever hos os - argumenterer for, at vi skal v
Hvorfor du skal være opmærksom på flueopkastKredit:Pixabay/CC0 Public Domain Ny forskning fra University of Massachusetts Amherst vedrørende synantropiske fluer - eller de ikke-bidende fluer, der lever hos os - argumenterer for, at vi skal v
- Hvilken slags binding finder sted i NaOH?
- Hvor hurtigt går en bold, når den rammer jorden, efter at det er faldet fra højden af 16 m Acce…
- Skjult olieudslip:Ny undersøgelse modsiger ejernes påstande
- Hvad er positive ved at bruge sol?
- Hvad er ledere af elektricitet?
- Efter jordskælv og oversvømmelser, Japan vælger katastrofe som 2018-symbol


