3-D bioprintet, vaskulariserede proksimale tubuli efterligner de menneskelige nyrer reabsorptionsfunktioner
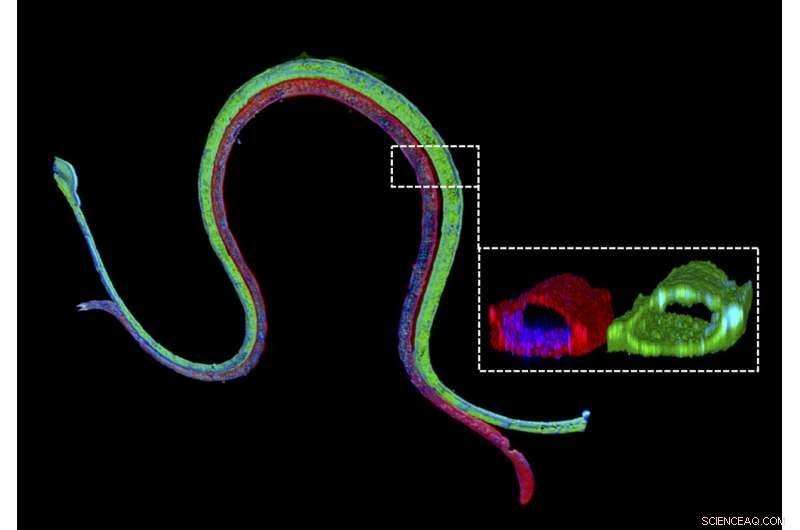
Immunfluorescensfarvning af en 3D-bioprintet vaskulariseret proksimal tubuli med en proksimal tubuliepitelmarkør farvet med grønt i den proksimale tubulikanal og en vaskulær endotelmarkør farvet med rødt i den tilstødende vaskulære kanal. Det forstørrede tværsnit illustrerer, at de to forskellige celletyper danner luminale perfuserbare strukturer i deres respektive kanaler. Kredit:Wyss Institute ved Harvard University
Hver dag tackler vores nyrer den skræmmende opgave at løbende rense vores blod for at forhindre spild, salt og overskydende væske fra opbygning inde i vores kroppe. For at opnå dette, nyrernes cirka en million filtreringsenheder (glomeruli) fjerner først både affaldsstoffer og dyrebare næringsstoffer fra blodbanen, derefter specialiserede strukturer kendt som de proksimale tubuli reabsorberer de "gode" molekyler og returnerer dem til vores blodbane. Mens de reabsorptive funktioner af den proksimale tubuli kan blive kompromitteret af lægemidler, kemikalier, eller genetiske og blodbårne sygdomme, vores forståelse af, hvordan disse effekter opstår, er stadig begrænset.
For at muliggøre studiet af nyreabsorption uden for den menneskelige krop, Wyss Institute Core Fakultet medlem Jennifer Lewis, Sc.D., og hendes team, der arbejder inden for Wyss Institutes 3-D Organ Engineering Initiative, som hun er med i spidsen for, og i samarbejde med Roche Innovation Center Basel i Schweiz, skabt en 3-D vaskulariseret proksimal tubuli-model, hvor uafhængigt perfuserbare tubuli og blodkar printes ved siden af hinanden i en konstrueret ekstracellulær matrix. Dette arbejde bygger på en kontinuerligt perfunderet 3-D proksimal tubuli-model rapporteret tidligere af teamet, der stadig manglede et funktionelt blodkarrum. Ved at bruge deres næste generations enhed, holdet har målt transporten af glukose fra den proksimale tubuli til blodkarrene, sammen med virkningerne af hyperglykæmi, en tilstand forbundet med diabetes hos patienter. Deres undersøgelse er offentliggjort i Proceedings of the National Academy of Sciences ( PNAS ).
Lewis er også Hansjörg Wyss professor i biologisk inspireret teknik ved Harvard John A. Paulson School of Engineering and Applied Science (SEAS), Jianmin Yu professor i kunst og videnskab og medlem af Harvard Stem Cell Institute.
"Vi konstruerer disse levende nyreanordninger på få dage, og de kan forblive stabile og funktionelle i flere måneder, " sagde førsteforfatter Neil Lin, Ph.D., som er Roche Fellow og Postdoc Fellow på Lewis' hold. "Vigtigt, disse 3-D vaskulariserede proksimale tubuli udviser de ønskede epitel- og endotelcellemorfologier og luminale arkitekturer, såvel som ekspression og korrekt lokalisering af vigtige strukturelle og transportproteiner, og faktorer, der tillader de rørformede og vaskulære rum at kommunikere med hinanden."
Som et første skridt mod at teste lægemidler og modellere sygdomme, holdet inducerede "hyperglykæmi", en tilstand med højt glukose, typisk for diabetes og en kendt risikofaktor for vaskulær sygdom, i deres model ved at cirkulere en fire gange højere end normal glucosekoncentration gennem det proksimale tubulirum. "Vi fandt ud af, at høje niveauer af glukose transporteret til endotelceller i det vaskulære rum forårsagede celleskade, " sagde Kimberly Homan, Ph.D., en medforfatter på undersøgelsen og Research Associate i Lewis' gruppe ved Wyss Institute og SEAS. "Ved at cirkulere et lægemiddel gennem tubuli, der specifikt hæmmer en større glukosetransportør i proksimale tubuli-epitelceller, vi forhindrede disse skadelige ændringer i at ske med endotelcellerne i de tilstødende kar."
Holdets umiddelbare fokus er at opskalere disse modeller yderligere til brug i farmaceutiske applikationer. "Vores system kunne muliggøre screening af fokuserede lægemiddelbiblioteker for nyretoksicitet og dermed hjælpe med at reducere dyreforsøg, " sagde Annie Moisan, Ph.D., en medforfatter og industrisamarbejdspartner på undersøgelsen, og Principal Scientist ved Roche Innovation Center Basel. "Jeg er begejstret for den fortsatte indsats fra os og andre for at øge den fysiologiske relevans af sådanne modeller, for eksempel ved at inkorporere patientspecifikke og syge celler, da personlig effektivitet og sikkerhed er de ultimative mål for at forudsige kliniske reaktioner på lægemidler."
"Vores nye 3D-nyremodel er et spændende fremskridt, da den mere fuldstændigt rekapitulerer de proksimale tubulisegmenter, der findes i naturligt nyrevæv, " sagde Lewis. "Ud over dets umiddelbare anvendelser til lægemiddelscreening og sygdomsmodellering, vi undersøger også, om disse levende enheder kan bruges til at øge nyredialyse." livreddende dialysemaskiner filtrerer blod, men de er ikke i stand til at hente dyrebare næringsstoffer og andre arter fra det filtrat, som kroppen har brug for til mange af sine funktioner, som kan forårsage specifikke mangler og komplikationer ned ad linjen. Lewis and her colleagues believe that 3-D bioprinted vascularized tubules may lead to improved renal replacement therapies.
"This study presents a significant step forward in human kidney engineering that enables human disease and drug-related studies to be carried out over extended periods of time in vitro. It also represents a major step forward for the Wyss Institute's 3-D Organ Engineering Initiative, which aims to generate functional organ replacements with enhanced functionalities for patients in need, " said Wyss Institute Founding Director Donald Ingber, M.D., Ph.D., who is also the Judah Folkman Professor of Vascular Biology at HMS and the Vascular Biology Program at Boston Children's Hospital, as well as Professor of Bioengineering at SEAS.
Sidste artikelStilanbefalinger fra dataforskere
Næste artikelDa nettet fylder 30, er det et ude af kontrol monster?
 Varme artikler
Varme artikler
-
 Hjernelignende computerchips kan afhjælpe bekymringer om privatlivets fred og drivhusemissionerProfessor Simon Browns papir offentliggjort i prestigefyldt fagfællebedømt tidsskrift Videnskab fremskridt beviser, at signaler på chipsene bemærkelsesværdigt ligner dem, der passerer gennem netværk
Hjernelignende computerchips kan afhjælpe bekymringer om privatlivets fred og drivhusemissionerProfessor Simon Browns papir offentliggjort i prestigefyldt fagfællebedømt tidsskrift Videnskab fremskridt beviser, at signaler på chipsene bemærkelsesværdigt ligner dem, der passerer gennem netværk -
 Ny e-tatovering muliggør nøjagtig, uafbrudt hjerteovervågning i dagevisStrækbar e-tatovering muliggør hjerteovervågning i dagevis. Kredit:Cockrell School of Engineering, University of Texas i Austin Den største dødsårsag i Texas er hjertesygdomme, ifølge National Cen
Ny e-tatovering muliggør nøjagtig, uafbrudt hjerteovervågning i dagevisStrækbar e-tatovering muliggør hjerteovervågning i dagevis. Kredit:Cockrell School of Engineering, University of Texas i Austin Den største dødsårsag i Texas er hjertesygdomme, ifølge National Cen -
 Biologisk inspireret hud forbedrer robotternes sensoriske evnerHver celle i denne kunstige hud udviklet af forskere ved det tekniske universitet i München (TUM) er udstyret med en mikroprocessor og sensorer til at registrere kontakt, acceleration, nærhed og tempe
Biologisk inspireret hud forbedrer robotternes sensoriske evnerHver celle i denne kunstige hud udviklet af forskere ved det tekniske universitet i München (TUM) er udstyret med en mikroprocessor og sensorer til at registrere kontakt, acceleration, nærhed og tempe -
 Spis med øjnene:Virtual reality kan ændre smagKredit:CC0 Public Domain Mennesker nyder ikke kun det søde, salte og salte fødevarer, men de er påvirket af det miljø, de spiser i. Cornell University fødevareforskere brugte virtual reality til a
Spis med øjnene:Virtual reality kan ændre smagKredit:CC0 Public Domain Mennesker nyder ikke kun det søde, salte og salte fødevarer, men de er påvirket af det miljø, de spiser i. Cornell University fødevareforskere brugte virtual reality til a
- Forskere udvikler et nyt biofotovoltaiksystem
- Rossi X-ray Timing Explorer rumfartøj til at genindtræde over troperne
- Ikke en sikker platform:Indien forbyder Zoom til offentlig brug
- Klimaændringer kan føre til flere landfaldende tropiske cykloner i Kina
- Skildpadde, der slugte fiskesnøre udgivet i havet
- Skelsættende EU -lovgivning er nyt våben for databeskyttelsesaktivisten Schrems (opdatering)


