Hvordan virker lithium-ion-batterier?
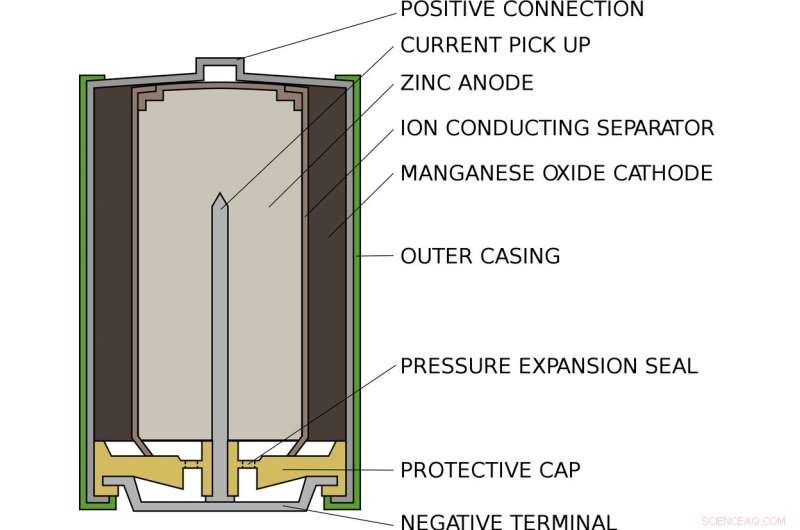
Sådan ser et standard AA alkalisk batteri ud på indersiden. Kredit:Lead holder/Wikimedia Commons
Smartphone-æraen er kun lidt over et årti gammel, men computere i lommeformat i hjertet af den samfundsmæssige transformation er kun virkelig mulige på grund af en anden teknologi:lithium-ion-batterier.
Først solgt kommercielt i 1991 af Sony for sine videokameraer, disse typer batterier er gode til meget mere end bærbar forbrugerelektronik. De er i centrum for to andre teknologiske revolutioner med magten til at transformere samfundet:overgangen fra forbrændingsmotorer til elektriske køretøjer, og skiftet fra et elnet drevet af fossile brændstoffer til vedvarende energigeneratorer, der lagrer overskydende elektricitet i batterier til fremtidig brug.
Så hvordan fungerer disse batterier? Forskere og ingeniører har brugt hele karrierer på at prøve at bygge bedre batterier, og der er stadig mysterier, som vi ikke helt forstår. Forbedring af batterier kræver, at kemikere og fysikere ser på ændringer på atomniveau, samt mekaniske og elektriske ingeniører, der kan designe og samle de batteripakker, der driver enheder. Som materialeforsker ved University of Washington og Pacific Northwest National Lab, mit arbejde har hjulpet med at udforske nye materialer til lithium-luft-batterier, magnesiumbatterier og selvfølgelig lithium-ion-batterier.
Lad os overveje en dag i livet for to elektroner. Vi vil navngive en af dem Alex, og han har en ven, der hedder George.
Batteriets anatomi
Alex bor inde i et standard alkalisk AA-batteri, som i din lommelygte eller fjernbetjening. Inde i et AA-batteri, der er et rum fyldt med zink og et andet fyldt med manganoxid. I den ene ende, zinken hænger kun svagt på elektroner som Alex. I den anden ende, manganoxidet trækker kraftigt elektroner mod sig selv. Ind i mellem, forhindrer elektronerne i at gå direkte fra den ene side til den anden, er et stykke papir gennemblødt i en opløsning af kalium og vand, som eksisterer side om side som positive kaliumioner og negative hydroxidioner.
Når batteriet sættes i en enhed og tændes, enhedens interne kredsløb er afsluttet. Alex bliver trukket ud af zinken, gennem kredsløbet og ind i manganoxidet. Langs vejen, hans bevægelse driver enheden, eller pære eller hvad der nu er tilsluttet batteriet. Da Alex går, han kan ikke komme tilbage:Det zink, der har mistet en elektron, binder sig til hydroxidet og danner zinkoxid. Denne forbindelse er ekstremt stabil og kan ikke nemt omdannes tilbage til zink.
På den anden side af batteriet, manganoxidet får et iltatom fra vandet og efterlader hydroxidioner for at balancere det hydroxid, der forbruges af zinken. Når alle Alexs naboer har forladt zinken og flyttet til manganoxidet, batteriet er opbrugt og skal genbruges.
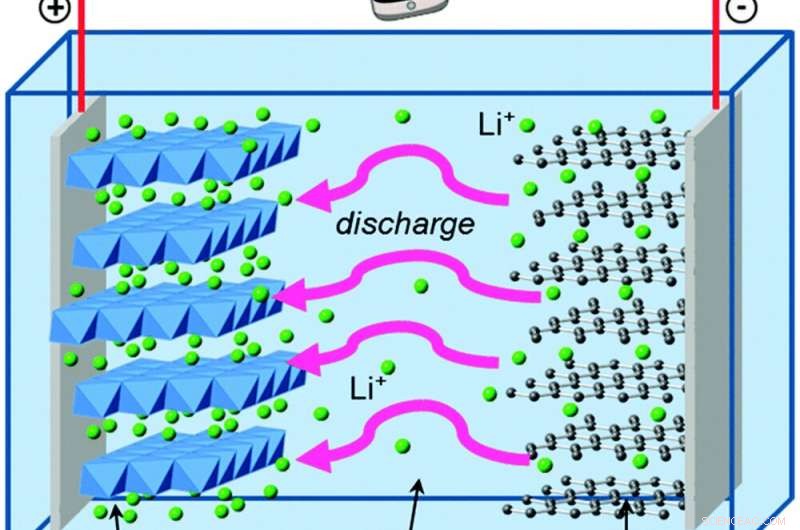
Når elektroner bevæger sig uden for batteriet, lithium-ioner bevæger sig inde i det for at holde den elektriske ligevægt. Kredit:Islam og Fisher, Chemical Society anmeldelser, 2014., CC BY
Lithium-ion fordele
Lad os sammenligne dette med George, der bor i et lithium-ion batteri. Lithium-ion-batterier har de samme grundlæggende byggesten som alkaliske AA-celler, med nogle få forskelle, der giver store fordele.
George lever i grafit, som er endnu svagere end zink til at holde på elektroner. Og den anden del af hans batteri er lithium cobalt oxid, som trækker elektroner meget kraftigere end manganoxid - hvilket giver hans batteri evnen til at lagre meget mere energi på samme plads end et alkalisk batteri. Opløsningen, der adskiller grafitten og lithiumkoboltoxidet, indeholder positivt ladede lithiumioner, som let danner og bryder kemiske bindinger, når batteriet aflades og genoplades.
Disse kemiske reaktioner er reversible, i modsætning til dannelsen af zinkoxid, hvilket er det, der lader elektronerne og lithiumionerne flyde frem og tilbage over mange cyklusser med opladning og afladning.
Denne proces er ikke 100 % effektiv, dog – alle batterier mister til sidst deres evne til at holde på energi. Alligevel, familien af Li-ion-kemier har været kraftige nok til at dominere batteriteknologien i dag.
Denne artikel er genudgivet fra The Conversation under en Creative Commons-licens. Læs den originale artikel. 
 Varme artikler
Varme artikler
-
 Airbnb sletter Japans annoncer forud for ny lejelovAirbnb og andre peer-to-peer-udlejningssider siger, at den nye lov fjerner usikkerhed i sektoren Udlejningsplatform Airbnb har suspenderet et stort flertal af sine annoncer i Japan forud for en ny
Airbnb sletter Japans annoncer forud for ny lejelovAirbnb og andre peer-to-peer-udlejningssider siger, at den nye lov fjerner usikkerhed i sektoren Udlejningsplatform Airbnb har suspenderet et stort flertal af sine annoncer i Japan forud for en ny -
 UAE's tekniske ambitioner plettet af internetrestriktionerDe Forenede Arabiske Emirater har investeret milliarder i nye teknologier og kunstig intelligens som en del af sin Vision 2021 udviklingsplan Med sin ultramoderne infrastruktur og hyperforbundne t
UAE's tekniske ambitioner plettet af internetrestriktionerDe Forenede Arabiske Emirater har investeret milliarder i nye teknologier og kunstig intelligens som en del af sin Vision 2021 udviklingsplan Med sin ultramoderne infrastruktur og hyperforbundne t -
 Anatomi af en bitcoin -transaktion:Køb af en brugt SubaruI denne 7. februar, 2018, Foto, et neonskilt, der hænger i vinduet til Healthy Harvest Indoor Havearbejde i Hillsboro, Malm., viser, at virksomheden accepterer bitcoin som betaling. Køb med bitcoin og
Anatomi af en bitcoin -transaktion:Køb af en brugt SubaruI denne 7. februar, 2018, Foto, et neonskilt, der hænger i vinduet til Healthy Harvest Indoor Havearbejde i Hillsboro, Malm., viser, at virksomheden accepterer bitcoin som betaling. Køb med bitcoin og -
 Platform til mobilnetværk vil bringe tjenester op til hastigheder på 100 GbpsSelvom efterspørgslen efter webtjenester vokser sammen med utallige internet of things-applikationer, en ny platform kunne gøre det muligt for netværk at levere hastigheder på op til 100 Gbps. Kredit:
Platform til mobilnetværk vil bringe tjenester op til hastigheder på 100 GbpsSelvom efterspørgslen efter webtjenester vokser sammen med utallige internet of things-applikationer, en ny platform kunne gøre det muligt for netværk at levere hastigheder på op til 100 Gbps. Kredit:
- Hvilke dyr viser commensalism i regnskoven?
- Meget forventet atomeksperiment i gang
- Politisk ustabilitet og svag regeringsførelse fører til tab af arter, undersøgelse finder
- Videnskaben omkring planeten bruger billeder af Jorden fra rumstationen
- Atomindustrien satser stort på små kraftværker
- Kim Dotcom kæmper mod amerikansk udlevering i New Zealands højesteret


