Forskere identificerer, hvordan et almindeligt tilsætningsstof giver lithium-ion-batterier et boost
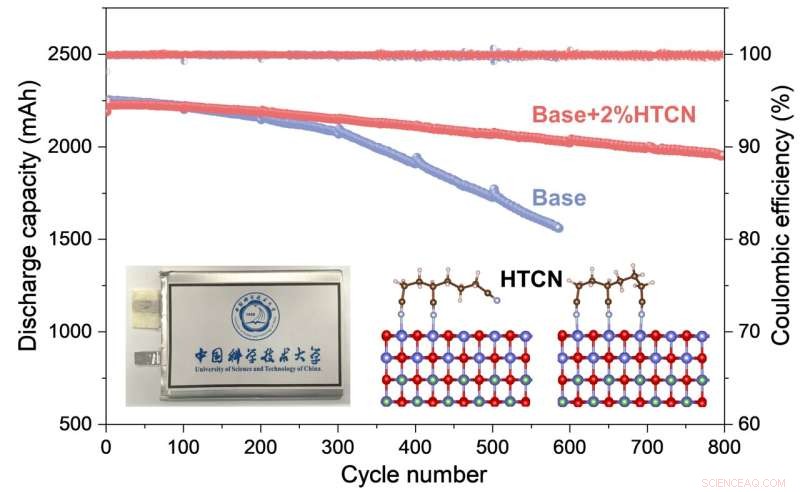
Den elektrokemiske ydeevne og arbejdsmekanismen for HTCN-additiv på højspændings LiCoO2 katode til praktiske poseceller er grundigt undersøgt. Kredit:Nano Research
Nitriler - en organisk forbindelse med et kulstofatom, der er tredobbelt bundet til et nitrogenatom - tilføjes almindeligvis til elektrolytformlen for batterier ved hjælp af en lithium-koboltoxidkatode, hvilket gør, at sådanne batterier kommer meget tættere på at realisere deres fulde teoretiske ydeevne. Indtil nu har batteriforskere ikke rigtig forstået, hvorfor disse nitriler virker på denne måde. Men en gruppe elektrokemikere har brugt avancerede mikroskopiteknikker til at se nærmere på, hvad der sker på molekylær skala og identificeret, hvad der foregår, hvilket åbner nye veje for endnu yderligere forbedringer af batteriets ydeevne.
Undersøgelsen blev offentliggjort i tidsskriftet Nano Research den 22. september 2022...
Lithium cobaltoxid (LiCoO2 , eller bare "LCO") er det mest udbredte materiale til katoder - de positive elektroder - i lithium-ion-batterier. Dette gælder især for batterier, der bruges i bærbare elektroniske enheder takket være LCO's høje driftsspænding, dens høje kapacitet og stabiliteten af dens ydeevne på lang sigt.
Men det, der har gjort LCO-katoder særligt attraktive, er, at de tilbyder mere energi til en mindre mængde plads (større energitæthed), hvilket er meget nyttigt for mindre forbrugerenheder såsom telefoner, smartwatches og gadgets, der har endnu strengere pladsbegrænsninger, f.eks. som husholdnings- og industrielle smarte sensorer.
Men i øjeblikket kan LCO-katoder kun levere omkring halvdelen af deres teoretiske specifikke kapacitet. Det betyder, at det, de rent faktisk leverer, er meget mindre, end det, de teoretisk burde kunne producere. Derfor har de ofte svært ved at opfylde de stigende krav til energitæthed fra bærbar elektronik.
En måde at omgå denne forhindring ville være at øge den begrænsede ladespænding af batterier ved hjælp af LCO-katoder. Den begrænsede ladespænding beskriver det punkt, hvor et batteri anses for at være fuldt opladet. Ud over dette punkt kan batteriet blive beskadiget, og så mange enheder slukker bare, når cut-off-tærsklen er ramt. Denne tærskel er noget vilkårligt sat, og derfor kunne den øges, og en sådan højspændingsdrift giver et løfte om at give et energitæthedsboost til sådanne batterier.
Men her opstår et nyt problem:Højspændingsdrift kan forværre skadelige kemiske reaktioner ved grænsefladen mellem katoden og elektrolytten. Dette kan resultere i revner og andre indre skader, som igen kan forringe grænsefladen mellem elektroderne yderligere. I sidste ende kan alt dette resultere i et radikalt fald i batterikapaciteten og en kraftig stigning i sikkerhedsproblemer. Arbejdstemperaturen i disse enheder kan nå 45 ℃ på grund af deres egen varmeudvikling, hvilket forkorter batteriets levetid yderligere.
Og så i nogen tid nu, at blande yderligere forbindelser til elektrolytformlen for at justere reaktionsaktiviteten af elektrolytten (mediet, der indeholder ioner, der hjælper med at etablere en strøm via bevægelsen af positive og negative ioner gennem det) ved grænsefladen mellem katoden og elektrolyt har vist sig at være en meget effektiv strategi til at reducere elektrolytreaktionsaktiviteten.
Der er en række forskellige forbindelser, der bruges som sådanne elektrolytadditiver, men til lithium-ion-batterier er nitriler måske de mest udbredte. Nitriler er enhver organisk forbindelse, der har en del af molekylet (en funktionel gruppe), der består af et kulstofatom, der er tredobbelt bundet til et nitrogenatom.
Imidlertid er arbejdsmekanismen for nitriladditiver på højspændingskatoder stadig ikke fuldt ud forstået, især i den slags praktiske, dagligdags højspændings LCO-posebatterier. (Pouch-batterier er en type "bløde" batterier uden et hårdt metalhus, og i stedet hvis komponenter er indesluttet i en aluminium-belagt plastikfilm, der ligner lidt en "pose" med tyggegummi eller løs tobak. Først udviklet i 1995 og giver mulighed for meget mere effektiv udnyttelse af pladsen, og posebatterier er siden blevet et almindeligt valg for producenter på grund af denne designfordel.)
Der er to hovedteorier, der forsøger at forklare mekanismen for nitriltilsætningsstoffer, men begge har betydelige mangler i deres forklaringsevne.
"Nitriller fungerer godt, men vi ved ikke rigtig, hvorfor de virker godt, hvorfor denne stabiliserende handling finder sted. Præcis hvad der foregår er forblevet ret mystisk," siger Shuhong Jiao, en elektrokemiker ved University of Science and Technology of China (USTC). "Og hvis vi ikke ved, hvorfor det, vi gør for at forbedre batterierne, virker, forhindrer det os i at justere vores indsats for at forbedre tingene yderligere."
Så forskerne tog et almindeligt nitrilelektrolyt-additiv, tridentatligand-holdig 1,3,6-hexantricarbonitril (eller mere simpelt HTCN) for at forsøge at kaste lys over, hvad nitrilers mekanisme er ved at stabilisere højspænding a LiCoO2 katode.
Mens batteriet var i drift, og langt bedre end tilsvarende uden HTCN-elektrolyttilsætningsstofferne, brugte forskerne elektronmikroskopi til at se nærmere på, hvad der skete, kombineret med en analyse af ion- og grundstofsammensætningen af systemet. De fandt ud af, at HTCN-additivet meget effektivt hæmmede dannelsen af revner og opløsningen af koboltioner.
Derefter fandt de ved hjælp af røntgenfotoelektronspektroskopi kombineret med en række teoretiske beregninger, at HTCN-molekylerne blev effektivt adsorberet på (klæbet til) overfladen af LCO og indlejret i grænsefladen mellem katoden og elektrolytten, som i drejning i høj grad hæmmer en oxidationsreaktion på overfladen af LCO og forhindrer derved en kontinuerlig nedbrydning af elektrolytten.
Alt i alt svarer dette til en meget mere stabil grænseflade mellem katode og elektrolyt, som væsentligt undertrykte nedbrydning af komponenter og dannelse af revner. Det er denne stabile og tætte katode-elektrolyt-struktur, der forbedrer batteriets stabilitet gennem rigtig mange cyklusser med opladning og afladning.
Ved at kende denne forståelse på molekylært niveau af, hvordan nitritilsætningsstoffer giver sådanne batterier et løft, kan forskere nu opsøge andre elektrolytadditivformuleringer, der producerer en lignende eller bedre grænsefladestruktur. + Udforsk yderligere
Kemiske tilsætningsstoffer forbedrer stabiliteten af lithium-ion-batterier med høj densitet
 Varme artikler
Varme artikler
-
 Google sætter den 2. april slutdato for Google+, download dine billeder og indhold inden daKredit:CC0 Public Domain Google har en officiel lukkedato for sit urolige Google+ sociale netværk:2. april. Søgemaskinegiganten siger på den dato, at Google+ konti og alle oprettede sider vil bli
Google sætter den 2. april slutdato for Google+, download dine billeder og indhold inden daKredit:CC0 Public Domain Google har en officiel lukkedato for sit urolige Google+ sociale netværk:2. april. Søgemaskinegiganten siger på den dato, at Google+ konti og alle oprettede sider vil bli -
 AI -teknologi adresserer nøjagtighed af dele, en stor fremstillingsudfordring inden for 3D-printDette billede illustrerer de faktiske forudsigelser af geometriske formafvigelser for 3-D lodrette halvcylindere, der genereres fra Purdue University maskinindlæringsteknologi. Kredit:Purdue Universit
AI -teknologi adresserer nøjagtighed af dele, en stor fremstillingsudfordring inden for 3D-printDette billede illustrerer de faktiske forudsigelser af geometriske formafvigelser for 3-D lodrette halvcylindere, der genereres fra Purdue University maskinindlæringsteknologi. Kredit:Purdue Universit -
 Chauffører af delvist automatiserede køretøjer får skylden for ulykker, som de ikke med rimeligh…Kredit:Pixabay/CC0 Public Domain Folk synes at holde den menneskelige chauffør for at være hovedansvarlig, når deres delvist automatiserede køretøj styrter. Men er dette rimeligt? I en artikel for
Chauffører af delvist automatiserede køretøjer får skylden for ulykker, som de ikke med rimeligh…Kredit:Pixabay/CC0 Public Domain Folk synes at holde den menneskelige chauffør for at være hovedansvarlig, når deres delvist automatiserede køretøj styrter. Men er dette rimeligt? I en artikel for -
 Japansk Toyota finder hjul, airbag-fix for tilbagekaldte elbilerEt logo for Toyota Motor Corp. hos en forhandler onsdag den 11. maj 2022 i Tokyo. Toyota sagde torsdag, oktober 6, 2022, at det har identificeret, hvordan man reparerer sine 2023 model år bZ4X crossov
Japansk Toyota finder hjul, airbag-fix for tilbagekaldte elbilerEt logo for Toyota Motor Corp. hos en forhandler onsdag den 11. maj 2022 i Tokyo. Toyota sagde torsdag, oktober 6, 2022, at det har identificeret, hvordan man reparerer sine 2023 model år bZ4X crossov
- Livscyklus for den gyldne ørn
- Storme Alpha og Beta opkaldt efter det græske alfabet, anden gang nogensinde
- Kunne vi klone vores organer til at blive brugt til en transplantation?
- Forhistoriske mennesker begyndte at sprede tamme bananer over hele verden 6, 000 år siden
- Data bekræfter voksende dødzone i Chesapeake Bay
- Halvleder qubits skalerer i to dimensioner


