Hvilke egenskaber bestemmer, om en løsning vil udføre en elektrisk strøm?
1. Tilstedeværelse af ioner:
* elektrolytter: Løsninger, der udfører elektricitet, kaldes elektrolytter. Disse opløsninger indeholder ioner (ladede atomer eller molekyler), der er fri til at bevæge sig.
* stærke elektrolytter: Disse adskiller sig fuldstændigt i ioner, når de blev opløst, hvilket fører til høj ledningsevne. Eksempler inkluderer stærke syrer (HCI, HNO3), stærke baser (NaOH, KOH) og de fleste ioniske salte (NaCl, KBR).
* svage elektrolytter: Disse adskiller sig kun delvist i ioner, hvilket resulterer i lavere ledningsevne. Eksempler inkluderer svage syrer (CH3COOH), svage baser (NH3) og nogle salte med lav opløselighed.
* ikke -elektrolytter: Disse adskiller sig ikke til ioner, når de opløses, hvilket gør dem til dårlige ledere af elektricitet. Eksempler inkluderer sukker, alkoholer og mange organiske forbindelser.
2. Koncentration af ioner:
* Jo højere koncentration af ioner i en opløsning, jo større er ledningsevnen. Dette skyldes, at flere ladningsselskaber er tilgængelige til at bære strømmen.
3. Temperatur:
* Generelt øges ledningsevnen med temperaturen. Når temperaturen stiger, bevæger sig ionerne hurtigere, hvilket fører til flere kollisioner og øget strømstrøm.
4. Opløsningsmidlets art:
* Opløsningsmidlet spiller en rolle i opløsningen af opløst stof og påvirkende ionmobilitet. Vand er et særligt godt opløsningsmiddel for mange ioniske forbindelser, hvilket gør vandige opløsninger meget ledende.
5. Mobilitet af ioner:
* Størrelsen og ladningen af ionerne påvirker deres bevægelse gennem løsningen. Mindre ioner og ioner med højere afgifter har en tendens til at være mere mobile, hvilket fører til højere ledningsevne.
I resuméet vil en opløsning udføre en elektrisk strøm, hvis den indeholder frit bevægende ladede partikler (ioner). Omfanget af konduktivitet afhænger af koncentrationen af ioner, deres mobilitet, arten af opløsningsmidlet og temperaturen.
Sidste artikelHvilken farve har linjetråden i et elektrisk system?
Næste artikelHvad er laboratorieudstyret og giver billede?
 Varme artikler
Varme artikler
-
 Træning af robotter til at identificere objektplaceringer ved at hallucinere scenerOier Mees demonstrerer, hvordan den nye tilgang fungerer. Kredit:Mees et al. Med flere robotter nu på vej ind i en række indstillinger, forskere forsøger at gøre deres interaktioner med mennesker
Træning af robotter til at identificere objektplaceringer ved at hallucinere scenerOier Mees demonstrerer, hvordan den nye tilgang fungerer. Kredit:Mees et al. Med flere robotter nu på vej ind i en række indstillinger, forskere forsøger at gøre deres interaktioner med mennesker -
 Hyundai Motors nettoresultat i første kvartal falder 48 pct.Hyundai Motor solgte 1,05 millioner biler i tremånedersperioden, et fald på 1,7 procent i forhold til året før Sydkoreas største bilproducent Hyundai Motor så sit nettooverskud i første kvartal fa
Hyundai Motors nettoresultat i første kvartal falder 48 pct.Hyundai Motor solgte 1,05 millioner biler i tremånedersperioden, et fald på 1,7 procent i forhold til året før Sydkoreas største bilproducent Hyundai Motor så sit nettooverskud i første kvartal fa -
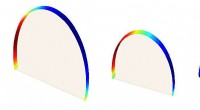 AI -teknologi adresserer nøjagtighed af dele, en stor fremstillingsudfordring inden for 3D-printDette billede illustrerer de faktiske forudsigelser af geometriske formafvigelser for 3-D lodrette halvcylindere, der genereres fra Purdue University maskinindlæringsteknologi. Kredit:Purdue Universit
AI -teknologi adresserer nøjagtighed af dele, en stor fremstillingsudfordring inden for 3D-printDette billede illustrerer de faktiske forudsigelser af geometriske formafvigelser for 3-D lodrette halvcylindere, der genereres fra Purdue University maskinindlæringsteknologi. Kredit:Purdue Universit -
 Foreløbig rapport:Etiopiens besætning fulgte Boeing -procedurerI denne onsdag den 13. marts, 2019 filfoto, en sørgende slægtning, der mistede sin kone i flystyrtet, bliver hjulpet af et medlem af sikkerhedsstyrker og andre i nærheden af Bishoftu, i Etiopien, på
Foreløbig rapport:Etiopiens besætning fulgte Boeing -procedurerI denne onsdag den 13. marts, 2019 filfoto, en sørgende slægtning, der mistede sin kone i flystyrtet, bliver hjulpet af et medlem af sikkerhedsstyrker og andre i nærheden af Bishoftu, i Etiopien, på


